Как приготовить раствор для: Как сделать и замесить цементный раствор для фундамента, кладки кирпича и стяжки
- Как сделать и замесить цементный раствор для фундамента, кладки кирпича и стяжки
- Как самому приготовить раствор химического вещества (реактива)
- Как приготовить раствор для оштукатуривания печи?
- Как приготовить строительный раствор или бетон
- Как приготовить известковый раствор для штукатурки своими руками. Как приготовить цементно-известковый раствор для штукатурки
- Как приготовить известковый раствор для штукатурки своими руками. Как приготовить цементно-известковый раствор для штукатурки
- Как приготовить известковый раствор для штукатурки стен. Как приготовить цементно-известковый раствор
- Как сделать цементный раствор липким. Пластификатор для цементного раствора
- Видео приготовление штукатурного раствора.
- Как приготовить питательный раствор для гидропоники?
- Как сделать раствор для штукатурки с пропорциями
- Глава 12.1: Подготовка растворов — Chemistry LibreTexts
- 2.5: Приготовление растворов — Химия LibreTexts
- Подготовка растворов
- Подготовка растворов | Химия для неосновных
- Подготовка растворов
- | Carolina.com
- Как приготовить раствор правильной концентрации
Как сделать и замесить цементный раствор для фундамента, кладки кирпича и стяжки
Состав цементного раствора зависит от множества факторов, среди которых первую позицию занимает область применения данного стройматериала. Существует три основных вида работ, для которых используется раствор на основе цементного вяжущего: кладка, штукатурка и изготовление стяжки для пола. Строители знают, что штукатурные смеси должны обладать более высокой пластичностью, в сравнении с растворами для стяжки или кладочными смесями. В то же время, процесс заливки пола раствором подразумевает уменьшения срока схватывания материала и значительных показателей прочности на сжатие, чего от штукатурных растворов никто не требует.
Независимо от того, для кирпича какой формы готовится смесь, марка кладочного раствора должна быть значительно ниже марки прочности кирпича. Состав смеси будет напрямую зависеть именно от её марки. Для примера приведём 2 соотношения цемента и песка, которые покажут, как замесить раствор марок М100 и М75. При использовании цемента М400 в первом случае пропорция будет 1:4,3, во втором — 1:5,5. Количество воды определяется экспериментально, готовый раствор не должен падать с мастерка, его консистенция обычно напоминает густую кашу. В бетономешалке 150 л объём ингредиентов будет следующим: 16 л цемента, 88 л песка и 12 л воды, чтобы получить раствор М75, М100 потребует тех же компонентов в количестве 19 л, 84 л и 13 л соответственно.
Для тех же марок материалов составим соотношения компонентов, если стоит вопрос как сделать цементно-известковый раствор. М100 получится при использовании 1 части цемента, 0,36 частей извести и 4,3 частей песка. М75 будет иметь пропорции 1:0,56:5,5. Технология изготовления раствора аналогичная тому, как приготовить цементный раствор для фундамента, штукатурки или кладки. Сначала в ёмкости смешиваются сухие ингредиенты в объёмных пропорциях, указанных выше, затем в раствор постепенно добавляется вода в небольших количествах. Ориентироваться можно на рекомендации производителя цемента, написанные на упаковке, но окончательные соотношения можно установить только на практике.
Ориентироваться можно на рекомендации производителя цемента, написанные на упаковке, но окончательные соотношения можно установить только на практике.
Для кладки печи цементно-песчаный раствор без добавок никогда не используется. Здесь нужно обязательно использовать как можно более чистый песок и достаточно жирную глину в соотношении 1:1,8 – 1:2,4. Допустимое количество цемента в данном случае составляет 1 часть на 12-15 частей песчано-глиняной смеси.
Как самому приготовить раствор химического вещества (реактива)
Если на этой странице вам непонятно – сделали ещё более упрощённый вариант объяснения – перейти…
Но если и там вам будет сложно – тогда мы бессильны.
Большинство реактивов, которые продаются в химических магазинах, находятся в сухом виде. Однако используются они обычно в виде растворов. Поэтому один из самых частых вопросов от наших покупателей – как из сухого вещества сделать раствор нужной концентрации.
Напоминаем, что все работы с химическими веществами следует проводить с соблюдением необходимых мер безопасности! Используйте средства индивидуальной защиты органов дыхания, глаз и кожных покровов!
В зависимости от способа и методики приготовления растворы можно разделить на приблизительные и точные. Вторые можно приготовить только в лабораторных условиях с использованием дорогостоящего оборудования и посуды.
С другой стороны, “точности” приблизительных растворов вполне достаточно для проведения домашних опытов, удаления ржавчины или загрязнения, очистки или обеззараживания воды в аквариуме или в бассейне, для таких хобби, как химическая металлизация, печать фотографий, выращивание кристаллов, изготовления мыла и свечей и многих других.
Растворение химических веществ может производится в разных средах – воде, спирте, кислотах и т.д. В этой статье мы будем говорить только о растворении в воде.
Что такое концентрация раствора?
Концентрацию раствора выражают в процентах, например 10% раствор или 0,5% раствор. Эта цифра показывает, сколько частей вещества приходится на 100 частей раствора.
Так, в 100 граммах 10%-го раствора поваренной соли находится 10 грамм соли и 90 грамм воды. А в 500 граммах 30%-го раствора гидроксида натрия содержится 150 грамм NaOH и 350 грамм воды. Один килограмм 0,2%-го раствора нитрата серебра состоит из 2 грамм нитрата серебра и 998 грамм воды.
Отметим, что существует разница между массовой концентрацией и объемной концентрацией растворов, и эта разница тем больше, чем больше концентрация растворенного вещества и плотность раствора.
Например, чтобы приготовить 1 килограмм 15%-го раствора NaCl нужно смешать 150 грамм соли и 850 грамм воды. Для приготовления же 1 литра 15%-го раствора NaCl понадобится уже 166,2 грамм NaCl и 941,8 грамм воды (при растворении соли в воде объём раствора несколько увеличится), и плотность увеличится с 1,000 (на самом деле 0,998) до 1,108.
Объясняется такая разница тем, что плотность солевого раствора выше, чем плотность чистой воды.
В этой статье, для упрощения, речь всегда будет идти о массовой концентрации раствора, то есть вес раствора будем измерять в граммах, а не в миллилитрах.
Приготовление водного раствора из сухого безводного реактива
Прежде всего, определитесь – какой вес раствора вам понадобится. Если раствор этого вещества нестабилен или он вам нужен для какой-то разовой работы – готовьте столько раствора, сколько нужно сейчас. Если же раствор хорошо хранится и используется время от времени, можно приготовить его с запасом.
Теперь рассчитаем количество вещества, которое нужно взять для приготовления определенной массы раствора определённой концентрации:
Масса вещества в граммах = (концентрация раствора в процентах) * (масса раствора в граммах/100)
Соответственно, масса воды вычисляется как разница между общей массой раствора и массой сухого вещества.
Пример 1: приготовим 5%-й раствор гидроксида натрия (NaOH) массой 500 грамм.
Масса NaOH = (5) * (500 гр/100) = 25 грамм.
Масса воды = 475 грамм.
Пример 2: приготовим 37%-й раствор аммония фосфорнокислого (NH4H2PO4) массой 750 грамм.
Масса (NH4H2PO4) = (37) * (750 гр/100) = 277,5 грмм.
Масса воды = 472,5 грамм.
Остаётся растворить навеску сухого реактива в рассчитанном объёме воды.
Приготовление раствора из водных солей (кристаллогидратов)
Если вам нужно приготовить раствор из вещества, содержащего кристаллизационную воду (например, медный купорос CuSO4*5H2O, хромокалиевые квасцы KCr(SO4)2*12H2O и тому подобные вещества), то методика расчетов меняется, чтобы учесть уже имеющуюся в веществе воду.
Опять же, начинаем с определения массы раствора, который мы хотим приготовить. Затем вычисляем, сколько вещества должно содержаться в растворе такой массы нужной нам концентрации – формула та же, что и при использовании безводных реактивов.
Масса вещества в граммах = (концентрация раствора в процентах) * (масса раствора в граммах/100)
Далее, пересчитываем массу вещества на кристаллогидрат. Для этого в справочниках (Яндекс или Google – наше всё) находим молярные массы безводной формы этого вещества и кристаллогидрата и вычисляем соотношение – сколько вещества в безводной форме содержится в кристаллогидрате. Так, если молярная масса кристаллогидрата 150 грамм/моль, а безводная форма этого вещества имеет молярную массу 70 грамм/моль, это значит, что в 150 грамм кристаллогидрата содержатся 70 грамм безводной формы вещества.
Определив, какое количество кристаллогидрата вещества нам нужно растворить, вычисляем необходимую массу воды.
Пример 1. Приготовим 500 грамм 15%-го раствора карбоната натрия 10-водного Na2CO3∙ 10H2O
Определяем массу карбоната натрия в 500 граммах 15%-го раствора:
Na2CO3 = (15) * (500 гр/100) = 75 грамм
Делаем пересчет массы на кристаллогидрат.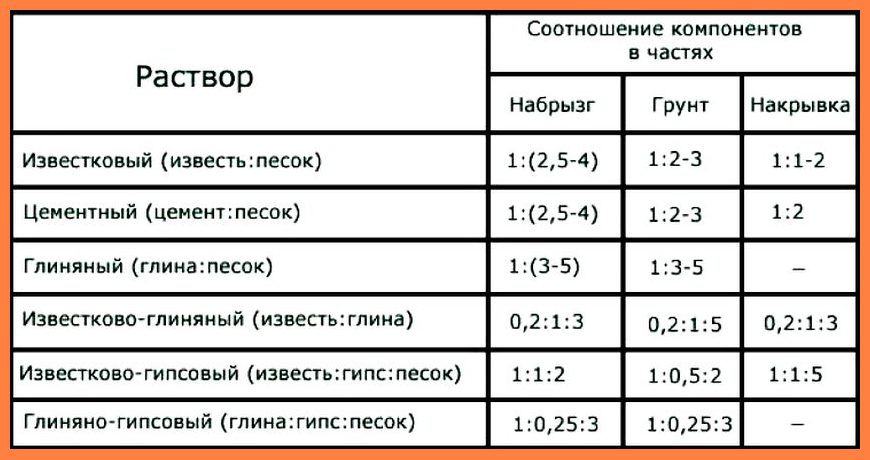 Молярная масса Na2CO3 = 106 грамм/моль, молярная масса Na2CO3∙ 10H2O = 286 грамм/моль. Таким образом, 286 грамм карбоната натрия 10-водного содержат 106 грамм карбоната натрия безводного.
Молярная масса Na2CO3 = 106 грамм/моль, молярная масса Na2CO3∙ 10H2O = 286 грамм/моль. Таким образом, 286 грамм карбоната натрия 10-водного содержат 106 грамм карбоната натрия безводного.
Нам нужно, чтобы в растворе оказалось 75 грамм карбоната натрия безводного. Составляем пропорцию и получаем, что нужно взять 202 грамма карбоната натрия 10-водного.
Последний шаг – посчитать нужное количество воды. 500 грамм минус 202 грамма = 298 грамм воды.
Пример 2. Приготовим 1000 грамм 3%-го раствора сульфата магния 7-водного MgSO4∙ 7H2O
Определяем массу сульфата магния в 1000 граммах 3%-го раствора:
MgSO4 = (3) * (1000 гр/100) = 30 грамм
Делаем пересчет массы на кристаллогидрат. Молярная масса (MgSO4) = 120 грамм/моль, молярная масса (MgSO4∙ 7H2O) = 246 грамм/моль.
Вычисляем, что для того, чтобы получить в растворе 30 грамм сульфата магния нужно взять 62 грамма сульфата магния 7-водного.
Смешиваем 938 грамм воды и 62 грамма сульфата магния 7-водного, получаем нужный результат.
Как приготовить раствор для оштукатуривания печи?
На сегодняшний день печь не играет такой важной роли, как это было еще сотню лет назад. Для отопления используются современные автономные котлы, снабженные продвинутыми системами электронного управления. Но они сильно зависят от поставки электричества и газа, а вот печь можно топить в любых условиях, были бы дрова.
Поэтому раствор для штукатурки печи нужно уметь готовить и в наши дни, ведь в своем доме никогда не помешает этот традиционный элемент русской культуры. При помощи дровяной печи можно не только отапливать дома, но и готовить очень вкусные блюда, которые ни при каких условиях не получатся в духовке. Многие хозяйки хорошо относятся к старославянской кухне, поэтому стараются повторять рецепты наших предков и сейчас.
Пропорции раствора
Сейчас уже только люди старшего поколения знают, как сделать раствор для штукатурки печи. Молодежь привыкла, что любые строительные материалы можно купить в специализированном гипермаркете, так что не нужно думать, как их там готовят. В состав обычно включают всего шесть основных компонентов, которые перемешивают до образования однородной массы.
От количества каждого вещества будет зависеть эксплуатационная пригодность раствора, так что нужно все тщательно выверять. Для создания рабочей смеси нужно будет подготовить следующие элементы:
- • термостойкую глину с максимальным показателем жирности;
- • обычный строительный цемент;
- • известь, измельченную до порошкового состояния;
- • гипс или мел;
- • кварцевый песок с мельчайшими фракциями;
- • асбест, который служит для адгезии и связи компонентов.
Пропорции раствора для штукатурки печи могут быть четырех типов. Выбор конкретного варианта зависит от материала, использованного при кладке и других сопутствующих моментов. Стоит заметить, что первые три компонента очень редко используются друг с другом, так как они взаимозаменяемы. Лишь отдельные случаи требуют использования сразу нескольких вяжущих веществ. А вот асбест входит в состав каждого раствора, потому что без него не получится добиться необходимого уровня прочности.
Можно добавлять в состав штукатурного раствора для печи и современные компоненты, которые помогут придать ему нужных свойств. Но перед этим нужно будет обязательно проверить свойства полученной смеси на небольшом участке. Лучше делать эксперименты с маленьким количеством раствора, чтобы не испортить много компонентов.
Большинство из них относится к категории дешевых, но все-таки большие лишние затраты никогда не приветствуются. Практически у каждого мастера в старину был свой собственный рецепт приготовления раствора, так что в ходе экспериментов можно найти отличный вариант.
Практически у каждого мастера в старину был свой собственный рецепт приготовления раствора, так что в ходе экспериментов можно найти отличный вариант.
Как готовить раствор для обмазывания печи?
После нахождения всех ингредиентов, нужно будет взять чистую емкость, которая будет служить для приготовления раствора для штукатурки печи. Но перед началом процедуры нужно пройти через подготовительный этап, который будет состоять из следующих шагов:
- 1. Все материалы должны состоять из мельчайших фракций и не иметь никаких крупных частиц, так как они будут серьезно мешать во время работы. Поэтому сырье просеивают через мелкое сито перед непосредственным смешиванием.
- 2. Вода должна быть комнатной температуры, примерно на уровне +20 градусов по Цельсию. Это оптимальный показатель для приготовления раствора.
- 3. Стоит учитывать, что чем больше цемента будет в составе, тем быстрее нужно работать со смесью, так как данный компонент уменьшает время застывания.
- 4. Перемешивать раствор нужно до образования однородного состава, в котором не будут присутствовать комки глины.
- 5. Очень важно не переусердствовать с водой, чтобы раствор не получился слишком жидким, так как тогда он попросту будет стекать со стенок печи.
Прочтение практических рекомендаций позволило узнать, как приготовить глиняный раствор для оштукатуривания печи. Теперь остается лишь использовать полученные навыки на практике. Никаких сложностей с этим возникнуть не должно, так как процесс предельно прост и понятен. А современные инструменты еще и помогут его упростить. Например, перемешивать штукатурку будет намного легче, если взять специальную насадку для дрели.
Если же есть желание использовать цементный раствор для штукатурки печи, то нужно готовить его небольшими порциями, так как израсходовать всю смесь нужно будет за 5-6 минут. По прошествии этого времени работать с ней уже будет очень сложно, а через полчаса она вообще становится непригодна к дальнейшей эксплуатации.
По прошествии этого времени работать с ней уже будет очень сложно, а через полчаса она вообще становится непригодна к дальнейшей эксплуатации.
Раствор нужен для кладки плитки
Если же параллельно с оштукатуриванием пользователь желает положить плитку, то подойдет только цементный раствор. Глина не будет обладать достаточным вяжущим свойством, чтобы удерживать на себе еще и декоративные элементы, которые имеют довольно внушительный вес. Лучше добавить побольше асбеста, который укрепит раствор и придаст ему необходимые технические характеристики для наилучшего выполнения возложенных функциональных обязанностей.
Раствор для штукатурки печки под плитку сохнет очень быстро, так что нужно заранее подготовить все материалы, чтобы не пришлось потом в суматохе бегать и искать их, пока приготовленная для кладки основа приходит в негодность. Выбирая плитку, нужно обязательно убедиться в ее термостойких свойствах, так как печь будет постоянно нагреваться и остывать, поэтому материал должен обязательно выдерживать подобные циклы.
Как приготовить строительный раствор или бетон
1 Состав строительного раствора
Строительные растворы служат для возведения стен из кирпича и бетонных блоков, используется для штукатурных работ и для выполнения бетонных стяжек.
Песок имеет различную фракцию в зависимости от его предназначения.
Совет
Храните цемент в сухом закрытом помещении.
Дозировка строительного раствора в расчете на один мешок цемента:
| Цемент вяжущий материал | Сухой строительный песок заполнитель | Вода | Пластификатор Добавляется в цементный строительный раствор для высокой пластичности |
| Назначение | Цемент | Сухой строительный песок Фракция 0,5 мм Плотность 1,5 г/м3 | Вода приблизительное количество | Пластификатор |
| Возведение стен из бетонных блоков Пример: блоки 20х20х50 см на 7 м2 | 50 кг | 190 кг или 127 л | 25 л | |
| Возведение стен из кирпича Пример: кирпич 120х250х65 мм на 7 м2 | 50 кг | 190 кг или 127 л | 25 л | + |
| Стяжка бетонного пола | 50 кг | 200 кг или 135 л | 25 л | |
| Традиционная фасадная штукатурка на 20 м2 Первый слой | 50 кг | 250 кг или 167 л | 25 л | |
| Цементноизвестковый второй слой Грунт 15-20 мм | 50+50 кг | 250 кг 167 л | 25 л | + |
| Цементноизвестковый третий слой Накрывка 5-7 мм | 20 кг | 190 кг 127 л | 25 л | + |
| Затирка для швов на каменной стене | 50 | 190 кг 127 л | 25 л | |
| Затирка для швов на кирпичной стене | 25 кг | 95 кг или 63 л | 13 л | + |
Чтобы получить качественную затирку для швов, перемешайте цемент и песок в сухом виде, просейте полученную смесь и лишь потом добавляйте воду. Количество пластификатора, который нужно добавить в раствор, зависит от производителя. Производитель сам указывает необходимое количество для разных растворов.
Количество пластификатора, который нужно добавить в раствор, зависит от производителя. Производитель сам указывает необходимое количество для разных растворов.
2 Состав бетона
Бетон служит для разнообразных строительных работ (фундамент, стяжка, балки, перекрытия и т.д.). Для увеличения прочности бетона в него помещают стальную арматуру, в результате чего получают железобетон.
Окисление металлической поверхности упрощает связывание бетона с арматурой.
| Цемент вяжущий материал | Сухой строительный песок | Гравий | Вода |
| Назначение | Вид арматуры | Цемент в мешках по 50 кг | Сухой строительный песок Фракция 0,5 мм Плотность 1,5 г/м3 | Щебень для бетона Фракция 20-40 мм Плотность 1,6 г/м3 | Вода |
| Бетонная стяжка, пол в гараже, терраса | Сварная арматурная сетка | 8 | 1200 кг (90 кг/мешок), или 800 л (60 л/мешок) | 850 кг (176 кг/мешок), или 530 л(110 л/мешок) | 175 л |
| Фундамент | Сетка для фундамента | 8 | 1200 кг (90 кг/мешок), или 800 л (60 л/мешок) | 850 кг (176 кг/мешок), или 530 л (110 л/мешок) | 175 кг |
| Балки, перекрытия | Квадратная арматурная сетка, прут стальной гладкий или рифленый | 8 | 720 кг (90 кг/мешок), или 490 л (60 л/мешок) | 850 кг (130 кг/мешок), или 530 л (81 л/мешок) | 200 л |
Как рассчитать необходимый объем бетона
| Объем бетона = Длина х Ширина х Высота Например: 10 х 5 х 0,1 м = 5 м3 |
Добавление воды в строительную смесь или бетон
| Объем воды = Вес цемента / 2 Например: 25 л воды на мешок цемента (50 кг) | Добавляйте воду постепенно, стараясь соблюдать пропорции. Превышение дозировки воды может привести к уменьшению прочности строительного раствора или бетона. Дозируйте воду в зависимости от желаемой консистенции раствора. Превышение дозировки воды может привести к уменьшению прочности строительного раствора или бетона. Дозируйте воду в зависимости от желаемой консистенции раствора. |
3 Приготовление смеси
Ручное приготовление строительного раствора или бетона
| 1. Насыпьте на чистый пол или в специальный бак горку песка (для строительного раствора) или песка и гравия (для бетона). 2. Соблюдая необходимые пропорции, насыпьте на горку песка цемент. Перемешайте смесь, перевернув ее лопатой два раза. 3. Сделайте сверху горки углубление в виде «кратера» и налейте в него воды. Подсыпайте сухую смесь с краев в центр до получения однородного раствора. |
Механическое приготовление раствора с помощью бетономешалки
Использование электрической бетономешалки позволяет:
— сэкономить время
— выполнить больший объем работ
— приготовить более однородную смесь
|
| вид смеси | Цемент | Песок | Щебень | Вода |
| Бетон для стяжки или фундамента | 25 кг | 80 кг или 40 л или 4 ведра или 8 лопат | 53 кг или 30 л или 3 ведер или 6 лопат | 12 л или 1,5 ведра |
Для получения 1 куб. м повторите операцию 14 раз (25 кг х 14 = 350 кг) м повторите операцию 14 раз (25 кг х 14 = 350 кг) | ||||
| Строительный раствор | 25 кг | 100 кг или 70 л или 7 ведер или 14 лопат | 12 л или 1,5 ведра | |
Одна лопата песка соответствует приблизительно 5 литрам. Перед работой проверьте, какой объем песка помещается на Вашу лопату.
Порядок работы
1. Налейте примерно 10 л воды в бак бетономешалки (в зависимости от вместимости бака).
Для приготовления строительного раствора добавьте песок. Для приготовления бетона добавьте сначала гравий, а затем песок.
2. Перемешивайте их в течение нескольких минут. Добавьте еще 2 литра воды и цемент.
3. При необходимости добавляйте воду до получения необходимой консистенции раствора или бетона.
Никогда не останавливайте бетономешалку во время перемешивания.
Некоторые модели бетономешалок позволяют останавливать ее с наполненным баком и снова запускать. Уточните у производителя, к какой категории относится ваша бетономешалка.
4 Готовые смеси для строительного раствора или бетона
Для облегчения и ускорения работы (особенно, если у вас нет специального оборудования) вы можете использовать готовые смеси для строительного раствора или бетона. В этом случае, добавив в готовую сухую смесь необходимое количество воды, вы получите однородный раствор и избежите риска, связанного с неправильной дозировкой.
Совет
Высыпьте содержимое мешка на укрытый куском полиэтилена пол для того, чтобы смесь не оставалась в углах мешка и чтобы легче было перемешивать ее с водой.
Виды готовых смесей
В отличие от смесей для бетона, существует большое разнообразие готовых смесей для строительных растворов. Вот их неполный список:
Вот их неполный список:
| Вид цементного раствора | Назначение | Примечание |
| Универсальный | Любые виды работ | |
| Цементно-известковый | Штукатурка и строительство кирпичных стен | Добавление извести увеличивает вяжущие свойства раствора и его пластичность |
| Отделочный | Штукатурка стен из бетона, кирпича и бетонных блоков | |
| Раствор с сокращенным временем схватывания | Ремонт и фиксация, требующая быстрого схватывания раствора | Время схватывания от 5 до 20 минут |
| Быстросхватывающийся | Фиксация, требующая очень быстрого схватывания раствора | Время схватывания 5 минут |
| Гидроизоляционный | Защита строений, находящихся во влажной среде или в непосредственном контакте с водой | |
| Ремонтный | Любые виды работ небольшого объема | |
| Клеящая смесь | Обшивка стен или строительство стен из блоков ячеистого бетона | |
| Затирочная смесь для швов | Затирка швов на стенах из камня, кирпича и т.п. |
Добавки
Приготовление строительных растворов с помощью добавок позволяет придать им дополнительные качества, необходимые для осуществления некоторых видов работ.
| Вид добавки | Назначение |
| Цветовая добавка | Окрашивает строительный раствор или бетон, используется для отделочных работ |
| Морозоустойчивая добавка | Увеличивает вяжущие свойства строительного раствора или бетона при отрицательных температурах |
| Вяжущая эпоксидная добавка | Служит для повышения твердости, пластичности и водонепроницаемости |
| Водоотталкивающая и гидроизолирующая добавка | Придает водонепроницаемость строительному раствору или бетону, используемому для строительства подземных фундаментов, резервуаров и бассейнов |
| Пластифицирующая добавка | Позволяет создавать более жидкие смеси (без увеличения пропорции воды), которые более просты в использовании |
| Замедлитель и ускоритель схватывания | Замедляет или ускоряет схватывание бетона |
Готовый бетон
| Этот бетон доставляется бетоновозом. Перемешивание бетона продолжается во время его перевозки, что сохраняет его качества. Оптимальный вариант для бетонирования больших объемов (вместимость бака бетоновоза 10м3). Бетон доставляется непосредственно на стройку. Это позволяет избежать финансовых вложений на дополнительное оборудование. |
Облегченный бетон
Для того чтобы уменьшить плотность бетона и использовать его в некоторых частях строений (полы чердачных помещений…), добавьте в него керамзит, гранулы пенополистирола…
Пример: пенополистирол увеличивает теплоизоляцию бетона. Внимание: прежде чем укладывать полы на облегченный бетон, сделайте армированную бетонную стяжку толщиной 4 см.
Внимание: прежде чем укладывать полы на облегченный бетон, сделайте армированную бетонную стяжку толщиной 4 см.
Как приготовить известковый раствор для штукатурки своими руками. Как приготовить цементно-известковый раствор для штукатурки
Как приготовить известковый раствор для штукатурки своими руками. Как приготовить цементно-известковый раствор для штукатурки
Предпочтения в выборе штукатурных составов для профессиональных строителей сводится к цементно-известковым смесям, особенно при финишной отделки стен кирпичной кладки. А все потому, что они имеют высокую пластичность и можно использовать, как для штукатурных работ, так и для вышеуказанной кладки блоков и тех же кирпичей.
Для приготовления цементно-известковых составов необходимыми являются: цемент, гашеная известь, песок и, конечно же, вода. А также следующие инструменты: ведро, строительное сито, удобная емкость для смешивания, совковая лопата и мастерок, строительный миксер.
И так, приступаем, непосредственно, к приготовлению:
- первым делом готовиться известковый раствор. Здесь все очень просто – гашеную известь (если взять негашеную или некачественно погашенную, то смесь будет рыхлой и ослабленной) разводим водой, пока не получим нужную консистенцию, которая будет напоминать молоко, как по цвету, так и по густоте. Для удаления комочков, пропускаем состав через сито;
- далее готовим смесь из цемента и песка (лучше речного, так как в нем содержится небольшое количество примесей), хорошо перемешав до однородного состава;
- следующий этап заключается в тщательном смешивании обеих составов, при необходимости, в который добавляется вода небольшими порциями до достижения нужного результата.
Такая техника приготовления используется и для кладочной, и для штукатурной смеси. Различие только в количестве используемых элементов.
Хотелось сделать акцент и на сильных сторонах цементно-известкового раствора:
- высокая пластичность – хорошо окутывает и соединяет материалы, положенные в кладку, кроме того, затвердевший состав почти не трескается;
- увеличивается время затвердения– дает возможность дольше работать;
- борьба с бактериями – так, как в состав входит известь, имеющая бактерицидные свойства и способствующая провести такую обработку;
- высокое прилипание к иным материалам –существует возможность обрабатывать большинство строительных материалов (к примеру, деревянные поверхности).

Выходя из вышесказанного можно сделать вывод, что для достижения поставленных целей и лучшего результата, рекомендуется изготавливать штукатурные смеси самостоятельно.
Как приготовить известковый раствор для штукатурки стен. Как приготовить цементно-известковый раствор
Цементно-известковая штукатурка в общих чертах готовится аналогично цементно-песчаной штукатурке, но вмест е с вод ой затворения добавляется известковое тесто .
Обычные пропорции раствора:
1 объемная часть цемента;
4–5 частей песка;
вода до достижения необходимой консистенции.
Пропорции компонентов для штукатурки. Таблица
Как правильно погасить известь. Технология приготовления известкового раствора
Для изготовления штукатурки используется известь. Она поставляется негашеная, в виде порошка, пасты или гранул. Перед приготовлением раствора ее необходимо погасить.
Важно!
Негашеная известь может раздражать кожу, а при смешивании ее с водой выделяются едкие испарения, поэтому при гашении необходимо использование защитных перчаток и респиратора.
Нельзя просто залить известь-пушонку водой: реакция пойдет очень бурно, с выделением тепла.
Найдите устойчивую к высокой температуре не пластиковую емкость, например, металлическое ведро или корыто. Налейте воду из расчета 5–6 л на 2 кг негашеной извести. Постепенно подсыпайте известь, тщательно, но аккуратно размешивая. Работу лучше производить вдвоем. Для полного гашения необходимо дать раствору постоять 1–2 часа, периодически размешивая, чтобы известь не оседала на дно. По окончании процесса получится белый, непрозрачный, похожий на молоко, раствор. Его используют вместо воды для приготовления цементно-известковой штукатурки.
Порядок приготовления штукатурного раствора
Для замеса штукатурного раствора применяют бетономешалку или строительный миксер. Небольшие порции раствора можно замесить лопатой или при помощи дрели.
Порядок смешивания может быть различным, но обычно сначала перемешивают песок и цемент, затем постепенно вливают воду или раствор извести.
Необходимо тщательно перемешать раствор, чтобы он получился однородным без комков.
Консистенция раствора как густая сметана, хотя для первого слоя иногда применяют более жидкую консистенцию.
Важно!
С цементно-известковым раствором можно работать 3–4 часа, это нужно учитывать при замесе штукатурки.
Техника безопасности
При работе с цементно-известковой и цементной штукатуркой надевайте одежду с длинным рукавом и резиновые перчатки для защиты рук. Также обязательно защитные очки, а при замешивании раствора – респиратор.
Как сделать цементный раствор липким. Пластификатор для цементного раствора
При выполнении строительных и ремонтных работ в значительных объемах используется бетон. Обидно, когда после длительного, затратного и трудоемкого процесса бетонирования через небольшое время бетонный массив покрывается сетью трещин и постепенно раскалывается. Чтобы этого не произошло, необходимо повысить эластичность цементного раствора. Для этого используются различные добавки.
Изготовив пластификатор для раствора своими руками, можно значительно сократить смету расходов на строительство и предотвратить растрескивание бетона после твердения. Итак, рассмотрим подробно, что такое пластификатор, из чего и как можно его изготовить своими силами.
Специалисты называют пластификатором материал на полимерной основе, служащий средством повышения пластичности строительных растворов
Что это такое – пластификатор для цементного раствора
Пластификатор для цемента представляет собой специальный состав, модифицирующий бетонную смесь, улучшающий ее эксплуатационные характеристики. Введение определенной присадки может, например, одновременно повышать пластичность, увеличивать морозостойкость и положительно влиять на процесс гидратации цемента. Благодаря введению специальных добавок снижается концентрация влаги, что облегчает кладку блоков и повышает качество бетонного монолита.
Пластификатор для цемента, введенный в бетонную смесь, выполняет ряд серьезных задач:
- повышает подвижность бетона;
- препятствует расслоению раствора;
- уменьшает объем добавляемой воды;
- улучшает прочностные характеристики;
- обеспечивает усиленный контакт со стальной арматурой;
- затрудняет насыщение массива разрушающей влагой;
- предотвращает растрескивание;
- способствует устойчивости бетона к перепадам температуры;
- увеличивает продолжительность хранения подготовленного цементного раствора;
- облегчает заполнение составом форм и выполнение кладки;
- снижает усадку в процессе гидратации.

Многие новички, пытаясь сэкономить, прибегают к самостоятельному изготовлению материала, используя для этого свой “индивидуальный” рецепт
Изготавливая пластификатор для раствора своими руками, важно обеспечить следующие характеристики присадки:
- Отсутствие токсичности. Добавка не должна отрицательно влиять на организм человека.
- Химическую стойкость. Состав не должен реагировать с другими ингредиентами цементной смеси.
- Сохранение консистенции. Присадка не должна испаряться при твердении бетона.
- Температуру применения. Добавка обязана соответствовать условиям введения в бетонный состав.
Соблюдение требований обеспечит требуемые качественные характеристики цементного раствора.
Мнение эксперта: Пластификатор цементного раствора
Пластификатор добавленный в бетон позволяет улучшить прочность и эластичность бетонной смеси. Домашний пластификатор для цемента конечно позволит сэкономить бюджет во время строительства, но лучше всего использовать промышленные пластификаторы. Так Вы обезопасите себя от возникновения ряда проблем, которые могут возникнуть в процессе твердения бетона с самостоятельно изготовленным пластификатором, которые могут испортить все дальнейшие строительные работы.
Дмитрий Орлов
Из чего сделать пластификатор для раствора своими руками
Где вы предпочли бы жить: в частном доме, или квартире?
Видео приготовление штукатурного раствора.
Как приготовить питательный раствор для гидропоники?
-
Какой тип воды лучше использовать? -
Фильтрации воды -
Рассмотрим некоторые виды фильтров -
Качество воды -
Жесткость воды -
Показатели pH и EC -
Как контролировать уровень pH? -
Как контролировать ЕС? -
Удобрения для гидропоники
Растения на 95 % состоят из воды. В ней протекают все биохимические реакции зеленых насаждений. Именно вода является амортизатором, метаболитом и донором электронов в фотосинтезе, участвует абсолютно во всех жизненных процессах, в том числе терморегуляции, обеспечивает транспортные функции у растений. Роль воды огромна, а потому к ее выбору для приготовления растворов в гидропонике нужно подходить с ответственностью.
В ней протекают все биохимические реакции зеленых насаждений. Именно вода является амортизатором, метаболитом и донором электронов в фотосинтезе, участвует абсолютно во всех жизненных процессах, в том числе терморегуляции, обеспечивает транспортные функции у растений. Роль воды огромна, а потому к ее выбору для приготовления растворов в гидропонике нужно подходить с ответственностью.
Начинающие растениеводы при подготовке питательного раствора нередко делают ошибку. Они полагают, что могут использовать любую воду, пригодную для питья. Вместе с тем не всякую воду можно применять в гидропонике в виду различий в составе. В разных регионах в него может входить хлористый натрий, губительный для насаждений, хлор, вредные гербициды, известь и высокий уровень железа. Перед тем, как использовать воду для приготовления раствора, нужно проверить ее основные параметры. Наиважнейший параметр – это уровень pH. Растения очень чувствительно к любым его изменениям, поэтому важно держать этот параметр на контроле.
Требования к воде
- минимальное содержание различных солей и минералов;
- отсутствие патогенной микрофлоры;
- отсутствие хлора;
- отсутствие ядов и инородных включений;
- нейтральная или слабокислая реакция.
Какой тип воды лучше использовать?
Колодезная вода перенасыщена марганцем, железом, минералами и солями, которые вобрала в себя из почвы. Она является очень жесткой. После получения заключения местно СЭС нужно такую воду фильтровать, умягчать, отстаивать.
Водопроводную допускается использовать после отстаивания. Это требуется для того, чтобы, чтобы улетучился хлор. В любом случае перед приготовлением раствора необходимо регулировать параметр рН такой воды.
Некоторые садоводы рекомендуют готовить раствор на основе дождевой воды. Она мягче остальных, насыщена кислородом и имеет нейтральную щелочную реакцию. Однако от района к району ее состав может меняться. В дождевой воде может присутствовать известь, тяжелые металлы, сажа и капли масла, а также вредные микроорганизмы, опасные для гидропонных растений. Чтобы получить наиболее полезную дождевую воду лучше приобрести подходящие для сбора емкости из инертных материалов. Однако проверкой качества воды после сбора пренебрегать не стоит.
Однако от района к району ее состав может меняться. В дождевой воде может присутствовать известь, тяжелые металлы, сажа и капли масла, а также вредные микроорганизмы, опасные для гидропонных растений. Чтобы получить наиболее полезную дождевую воду лучше приобрести подходящие для сбора емкости из инертных материалов. Однако проверкой качества воды после сбора пренебрегать не стоит.
Безопаснее всего использовать дистиллированную или осмотическую воду. Её недостаток состоит лишь в том, что определенных веществ (в особенности кальция) для роста растений может не хватать, но при приготовлении питательного раствора их концентрацию можно повысить. Вместе с тем данный вариант совсем не подходит для огромных оранжерей, так как процесс дистилляции требует слишком много времени и является энергозатратным.
Фильтрация воды
Очистить воду от вредных примесей можно разными способами. Все они делятся на несколько групп:
-
физико-механические; -
химические; -
физико-химические; -
биологические.
Рассмотрим некоторые виды фильтров
Фильтры на основе активированного угля помогают очистить жидкость от пестицидов, гербицидов, хлора и другой химии. Однако для борьбы с неорганическими соединениями они не подходят.
Керамические фильтры помогают очистить воду через микроскопические поры в керамической материи. Работают в паре с угольным фильтром. Не подходят для очистки от солей.
Метод озонирования эффективен в отношении вирусов и бактерий. Он также борется с размножением водорослей. Побочных продуктов в процессе фильтрации не выделяется.
Ультрафиолетовые фильтры также применяются для борьбы с патогенами. Их главный минус – низкая скорость обработки жидкости. К другим недостаткам относится разрушение хелатов, которые нужны растениям, чтобы удерживать необходимые для развития металлы.
Самым популярным является метод обратного осмоса. Он используется в гидропонике наиболее активно. Дает очень высокие результаты очистки. Вода обратного осмоса почти не содержит солей и считается оптимальной для приготовления растворов. Ее можно использовать без опасения превысить допустимый уровень EC. Однако ее чистота наделяет ОС-воду буферными свойствами. В связи с этим профессиональные агрономы рекомендуют примешивать 20 % водопроводной воды для раствора.
Качество воды
Качество воды определяется набором ее характеристик. Это электропроводность, уровень pH и показатель концентрации солей в питательном растворе.
Жесткость воды
Жесткость показывает количество растворенных ионов кальция и магния. Превышение показателя плохо сказывается на развитии растений. Для различных культур свой показатель. Так быстрорастущие насаждения потребляют ежедневно по 165—185 мг/л кальция. Превышать эти цифры нельзя. Однако и снижения жесткости говорит о недостатки важных микроэлементов.
Рекомендуется использовать составы для жесткой воды, если содержание кальция в воде составляет 60-90 мг/л. Если эти цифры более 140 мг/л, требуется фильтрация, чтобы замкнутая система работала нормально.
Показатели pH и EC
Для получения хороших урожаев в гидропонных системах необходимо следить за тем, чтобы основные показатели раствора держались в пределах допустимых значений. К таким показателям относится EC и pH.
РH – водородный показатель, который показывает соотношение ионов и анионов в воде. Если преобладает H+, баланс сдвигается в сторону кислотного, если OH- — щелочного. В гидропонной системе уровень pH должен держаться в пределах 5,8-6,2. Уход в кислотную среду приводит к нарушению всасываемости многих микроэлементов, в том числе кальция, магния, марганца и фосфора. Защелачивание приводит к оседанию солей на корнях растений и ограничению поступления железа. В результате насаждения заболевают, их рост останавливается.
В результате насаждения заболевают, их рост останавливается.
Наряду с кислотно-щелочным балансом необходимо следить и за уровнем ЕС. Под аббревиатурой понимается электролитическая проводимость (электропроводность), то есть способность раствора проводить электроток. Высокий уровень показателя говорит о высокой концентрации солей, при которой растительности сложно впитывать воду. Низкий показатель свидетельствует о том, что раствор потерял свою ценность. Таким образом, контроль над показателями ЕС помогает обеспечить растения достаточным количеством влаги, а также предотвратить излишнее накопление солей.
Для различных этапов жизненного цикла растений необходимо подготавливать питательную смесь, ориентируясь на показатель электропроводности. В условиях слишком низкой проводимости вырастет вытянутая культура. Если проводимость излишне высока, получится насаждение с маленьким межузловым расстоянием. Для снижения данного значения в раствор нужно добавить воду, для повышения – удобрения. Если же значение снизилось более чем на треть, раствор требует замены. Добавлять в него питательные элементы нельзя!
Как контролировать уровень pH?
Показатель pH можно проконтролировать разными способами. Например, при помощи специальных приборов. Если используется жидкий тест, нужно добавить несколько капель в раствор и идентифицировать результат согласно цветам в таблице. Такой анализ не может исключить ошибку, связанную с человеческим фактором. В этом плане портативный pH-метр удобнее. Он сразу выводит цифры на дисплей. Погрешность измерений ничтожно мала – до 0,1.
Для контроля над уровнем pH подойдет удобный и недорогой прибор KL-009 I(A). Он работает от батареек и подходит для применения не только питательных растворов, но и воды для полива, которые имеют температуру от 0 до + 50 °С.
Если анализ показал отклонения значения от нормы, то в таком случае необходимо использовать регуляторы pH UP и pH Down. Первый сдвигает водородный показатель вверх, второй понижает его.
Первый сдвигает водородный показатель вверх, второй понижает его.
Как контролировать ЕС?
Для измерения удельной проводимости используют ЕС-метры. Эти приборы также называют кондуктометры. Не только новичкам, но и опытным гроверам при применении минеральных удобрений следует иметь данный прибор. В свой арсенал рекомендуем приобрести модель AP-2. Прибор хорош тем, что определяет не только электропроводность, но также и температуру раствора. Погрешность в измерениях составляет не более 2 %.
Удобрения для гидропоники
Для того чтобы подготовить питательную смесь для растений, выращиваемых методом гидропоники, нужно в подготовленную воду добавить удобрения. Лучше всего для подкормки растений подходят готовые комплекты удобрений. Для применения в гидропонике подходят минеральные и органоминеральные удобрения. Однако при применении органики в гидропонике, требуется внесение микроорганизмов, например, таких как BioMagic SubCulture.
Как сделать раствор для штукатурки с пропорциями
Вот, кажется же, что приготовить раствор для штукатурки не составит никаких проблем. Как делает обычный рядовой человек: просеивает песок, добавляет цемент, мешает, добавляет воды, опять мешает и вуаля! Готово. А вот и нет. Настоящие профессионалы своего дела скажут, что каждой штукатурной операции — свой раствор. Поэтому давайте рассмотрим различные способы приготовления растворов для осуществления штукатурных работ, которые состоят из таких этапов: подготовка песка, подготовка и применение вяжущих материалов, а затем уже приготовление раствора.
Вяжущие вещества
Давайте рассмотрим основные виды вяжущих веществ. Чаще всего используется строительная известь, гипс, цемент или глиняная смесь.
Строительная известь
Важно то, что строительная известь может отвердеть только при доступе кислорода. И в зависимости от степени приготовления, она может делиться на негашеную (она же «кипелка») и гашеную («пушенка»). Запомните! Для приготовления раствора использовать можно только погашенную известку, поскольку все растворы затворяются водой, а при взаимодействии негашеной извести с водой начнется стихийный процесс гашения. Тогда в растворе могут остаться небольшие непогашенные частицы, которые взаимодействуют с влагой воздуха. В результате штукатурка начнет вздуваться.Чтобы погасить кипелку, лучше используйте бочку или ящик. Быстрогасящуюся известку (8 минут) засыпают в резервуар с водой, которая покроет всю кипелку. При появлении пара добавляйте воду и тщательно перемешивайте. Среднегасящуюся известь (25 минут) засыпают в емкость на четверть и заливают водой до половины. При появлении пара перемешивайте кипелку и доливайте воду. Если же известь медленногасящаяся (от 25 минут), то засыпайте в резервуар и немного увлажните водой. Под влиянием воды материал начнет разрушаться, и его объем увеличится в 2-3 раза. Тогда у извести температура повышается, и она начинает «кипеть».
Запомните! Для приготовления раствора использовать можно только погашенную известку, поскольку все растворы затворяются водой, а при взаимодействии негашеной извести с водой начнется стихийный процесс гашения. Тогда в растворе могут остаться небольшие непогашенные частицы, которые взаимодействуют с влагой воздуха. В результате штукатурка начнет вздуваться.Чтобы погасить кипелку, лучше используйте бочку или ящик. Быстрогасящуюся известку (8 минут) засыпают в резервуар с водой, которая покроет всю кипелку. При появлении пара добавляйте воду и тщательно перемешивайте. Среднегасящуюся известь (25 минут) засыпают в емкость на четверть и заливают водой до половины. При появлении пара перемешивайте кипелку и доливайте воду. Если же известь медленногасящаяся (от 25 минут), то засыпайте в резервуар и немного увлажните водой. Под влиянием воды материал начнет разрушаться, и его объем увеличится в 2-3 раза. Тогда у извести температура повышается, и она начинает «кипеть».
Яма для гашения извести
Как только появились трещины, начинайте доливать воду небольшими порциями и потихоньку перемешивать. В таком случае все тяжелые частицы осядут на дно резервуара. Затем все типы извести обычно разбавляются водой, до получения полной консистенции, смахивающей на известковое молочко, которое нужно процедить через специальное сито и слить в яму для гашения извести (на фото сверху). Спустя сутки, сверху насыпают предварительно просеянный песок, а затем еще земля общим слоем до 0.5 м.
Важно! Кипелка держится в яме не менее чем полмесяца. Не торопитесь, дайте извести полностью погаситься. Тогда молочко «превращается» в тесто, которое обладает сметанообразной густотой.
Строительный гипс
Следующий вяжущий элемент — это строительный гипс, применяющийся в штукатурной работе в качестве присадки к раствору известковой штукатурки и позволяющий увеличить качество смеси. При разбавлении водой, гипс схватывается уже спустя пять минут и за 30-ть минут он полностью застывает. Пожалуй, это фактически единственное в своем роде вяжущее вещество, не дающее существенной усадки и имеющее возможность использования в чистом виде.
Пожалуй, это фактически единственное в своем роде вяжущее вещество, не дающее существенной усадки и имеющее возможность использования в чистом виде.
Цемент
Что ни говори, но цемент считается самым прочным вяжущим веществом. Более высокий уровень марки — более прочен цемент. В растворах же используется м400. Материал отвердевает в воздухе и в воде. Схватывается через 15 минут, а сам процесс можно считать завершенным не позднее чем через один день после залития водой. Полностью становится прочным и твердым только через полмесяца.
Глина
Глина — это тоже вяжущее вещество, но оно применяется при оштукатуривании саманных и деревянных стен или при строительстве печей.
Наполнители
Теперь очередь наполнителей раствора. Самый известный — это песок. Но наиболее качественный песок — это речной кварцевый. В морском много солей, а вот овражный или горный может быть смешан с глиной. В крупнофракционном песке зерна составляют 2/4 мм, в среднефракционном – 0.5/2 мм, в мелком — 0.25/0.5 мм. Для осуществления работ, будет лучше, если использовать средние, реже крупнозернистые. Мелкие берите только для накрывки. Песок для раствора должен быть чистым и без всяких примесей. Поэтому перед работой его важно просеять через сито с ячейки в 3/4 мм. Если же вам необходимо много штукатурной смеси, используйте наклонное сито. А если объем работ невелик, то возьмите обычное ящичное сито.
Приготовление штукатурных растворов
Какими только не бывают растворы: известковые, цементные, глиняные и другие, более сложные по составу. Когда вы делаете раствор, то старайтесь добиться оптимальных пропорций наполнителя и вяжущего вещества. Такие смеси называются нормальными.
Цементно-песчаный раствор
Чтобы изготовить цементно-песчаный раствор, нам необходимы цемент, песок и вода. Песок советуется брать карьерный. После того как вы выбрали песок, его необходимо подготовить и удалить инородные материалы. Для просеивания применяем сито. Лучше всего брать сито размеров 3х3 мм для накрывки 1,5х1,5 мм. Чтобы удалить глинистые примеси, песок важно промыть. А как проверить цемент на свежесть? Берем в руку и сжимаем: если он вытек, то он свежий и отвечает всем параметрам, указанным на этикетке. Если же он стал комковаться, то все основные свойства цемента утеряны, и для приготовления раствора тогда понадобится больше цемента. Определить это можно опытным путем.
Цементно-известковый раствор
Приготовление оного практически идентично приготовлению цементного раствора. Только, помимо повторения всех действий, здесь еще необходимо подготовить известь. Известь разводится до консистенции известкового молока и процеживается через сито с ячейками 2х2 мм. Затем на основе известкового молока раствор замешивается и доводится до необходимой консистенции путем добавления воды.
Известковый раствор
Приготовление известкового раствора обладает определенной спецификой. Сперва необходимо подготовить все необходимые компоненты. Затем сперва добавляется определенное количество извести, а затем при постепенном помешивании добавляется песок. Обычно известковый раствор готовится при применении одной порции извести и трех порций песка.
Важно! Проверьте прочность известкового раствора: возьмите семь кирпичей и скрепите их известковым раствором в столбик, дав им высохнуть. Если раствор удерживает столб из семи кирпичей, то он сделан качественно.
Глиняный раствор
Как готовить глиняный раствор? Обычно поступают так: глину замачивают до ее полного размягчения. Затем она процеживается через сито с ячейками 2х2 мм, и к этой порции добавляется 2-4 порции песка, в зависимости от показателя жирности глины.
Известково-гипсовый раствор
Его готовят небольшими порциями, потому что он схватывается в течение 10-15 минут. Для раствора готовят известковое молоко, а потом в молоко добавляется гипс. NOTA BENE!!! И этот раствор в течение 10 минут нужно использовать! Его можно приготовить при помощи специальный сухих смесей, которые разбавляются водой. К примеру, это простая шпаклевка.
Механизм подготовки различных растворов практически идентичен, так что вам в пособие как готовить цементно-песчаный штукатурный раствор. Смотрим:
Глава 12.1: Подготовка растворов — Chemistry LibreTexts
- Последнее обновление
- Сохранить как PDF
- Приготовление растворов
- Пример 12.1.1
- Пример 12.1.2
- Пример 12.1.3
- Концентрации ионов в растворе
- Пример 12.1.4
- Ключевые уравнения
- Резюме
- Ключевые выводы
- Концептуальные проблемы
- Ответ
- Числовые задачи
- Ответы
- Участники
Цель обучения
- Для количественного описания концентраций растворов.
В разделе 9.3 мы описали различные способы определения концентрации раствора, молярности (M), моляльности (m), процентной концентрации и мольной доли (X).Количество растворенного вещества, растворенного в определенном количестве растворителя или раствора. раствора описывает количество растворенного вещества, которое содержится в определенном количестве растворителя или раствора. Знание концентрации растворенных веществ важно для контроля стехиометрии реагентов для реакций, протекающих в растворе. В этом разделе описывается, как можно приготовить растворы из основного раствора известной концентрации
.
Приготовление растворов
Чтобы приготовить раствор, который содержит определенную концентрацию вещества, необходимо растворить желаемое количество молей растворенного вещества в достаточном количестве растворителя, чтобы получить желаемый конечный объем раствора.
\ (Молярность раствора = dfrac {моль \: of \: solute} {Объем раствора} \ tag {12.1.1} \)
Рисунок 12.1.1 иллюстрирует эту процедуру для раствора дигидрата хлорида кобальта (II) в этаноле. Обратите внимание, что объем растворителя не указан. Поскольку растворенное вещество занимает пространство в растворе, необходимый объем растворителя почти всегда на меньше , чем желаемый объем раствора. Например, если желаемый объем был 1,00 л, было бы неправильно добавлять 1.00 л воды на 342 г сахарозы, потому что это даст более 1,00 л раствора. Как показано на рисунке 12.1.2, для некоторых веществ этот эффект может быть значительным, особенно для концентрированных растворов.
Рисунок 12.1.1 Приготовление раствора известной концентрации с использованием твердого вещества
Рисунок 12.1.2 Приготовление 250 мл раствора (NH 4 ) 2 Cr 2 O 7 в воде
Растворенное вещество занимает пространство в растворе, поэтому для приготовления 250 мл раствора требуется менее 250 мл воды.
Пример 12.1.1
Раствор на рисунке 12.1.1 содержит 10,0 г дигидрата хлорида кобальта (II), CoCl 2 · 2H 2 O, в этаноле, достаточном для приготовления ровно 500 мл раствора. Какова молярная концентрация CoCl 2 · 2H 2 O?
Дано: масса растворенного вещества и объем раствора
Запрошено: концентрация (M)
Стратегия:
Чтобы найти количество молей CoCl 2 · 2H 2 O, разделите массу соединения на его молярную массу.Рассчитайте молярность раствора, разделив количество молей растворенного вещества на объем раствора в литрах.
Решение:
Молярная масса CoCl 2 · 2H 2 O составляет 165,87 г / моль. Следовательно,
\ (молей \: CoCl_2 \ cdot 2H_2O = \ left (\ dfrac {10.0 \: \ cancel {g}} {165 .87 \: \ cancel {g} / mol} \ right) = 0 .0603 \: mol \)
Объем раствора в литрах
\ (volume = 500 \: \ cancel {mL} \ left (\ dfrac {1 \: L} {1000 \: \ cancel {mL}} \ right) = 0.500 \: L \)
Молярность — это количество молей растворенного вещества на литр раствора, поэтому молярность раствора составляет
.
\ (молярность = \ dfrac {0,0603 \: mol} {0,500 \: L} = 0,121 \: M = CoCl_2 \ cdot H_2O \)
Упражнение
Раствор, показанный на рисунке 12.1.2, содержит 90,0 г (NH 4 ) 2 Cr 2 O 7 в достаточном количестве воды, чтобы получить конечный объем ровно 250 мл. Какова молярная концентрация дихромата аммония?
Ответ: (NH 4 ) 2 Cr 2 O 7 = 1.43 млн
Чтобы приготовить конкретный объем раствора, который содержит указанную концентрацию растворенного вещества, нам сначала нужно рассчитать количество молей растворенного вещества в желаемом объеме раствора, используя соотношение, показанное в уравнении 12.1.1. Затем мы переводим количество молей растворенного вещества в соответствующую массу необходимого растворенного вещества. Эта процедура проиллюстрирована в Примере 12.1.2.
Пример 12.1.2
Так называемый раствор D5W, используемый для внутривенного замещения биологических жидкостей, содержит 0.310 М. глюкозы. (D5W представляет собой примерно 5% раствор декстрозы [медицинское название глюкозы] в воде.) Рассчитайте массу глюкозы, необходимую для приготовления пакета D5W объемом 500 мл. Глюкоза имеет молярную массу 180,16 г / моль.
Дано: молярность, объем и молярная масса растворенного вещества
Запрошено: Масса растворенного вещества
Стратегия:
A Рассчитайте количество молей глюкозы в указанном объеме раствора, умножив объем раствора на его молярность.
B Получите необходимую массу глюкозы, умножив количество молей соединения на его молярную массу.
Решение:
A Сначала мы должны вычислить количество молей глюкозы, содержащихся в 500 мл 0,310 М раствора:
\ (V_L M_ {моль / л} = моль \)
\ (500 \: \ cancel {mL} \ left (\ dfrac {1 \: \ cancel {L}} {1000 \: \ cancel {mL}} \ right) \ left (\ dfrac {0 .310 \: моль \: глюкоза} {1 \: \ cancel {L}} \ right) = 0.155 \: моль \: глюкоза \)
B Затем мы переводим количество молей глюкозы в требуемую массу глюкозы:
\ (масса \: of \: глюкоза = 0,155 \: \ cancel {моль \: глюкоза} \ left (\ dfrac {180.16 \: g \: глюкоза} {1 \: \ cancel {моль \: глюкоза}} \ справа) = 27,9 \: г \: глюкоза \)
Упражнение
Другой раствор, обычно используемый для внутривенных инъекций, — это физиологический раствор, 0,16 М раствор хлорида натрия в воде. Рассчитайте массу хлорида натрия, необходимую для приготовления 250 мл физиологического раствора.
Ответ: 2,3 г NaCl
Раствор желаемой концентрации также можно приготовить путем разбавления небольшого объема более концентрированного раствора дополнительным растворителем. Базовый раствор — это коммерчески приготовленный раствор известной концентрации, который часто используется для этой цели. Разбавление основного раствора является предпочтительным, поскольку альтернативный метод взвешивания крошечных количеств растворенного вещества трудно осуществить с высокой степенью точности. Разбавление также используется для приготовления растворов из веществ, которые продаются в виде концентрированных водных растворов, таких как сильные кислоты.
Процедура приготовления раствора известной концентрации из основного раствора показана на рисунке 12.1.3. Это требует расчета желаемого количества молей растворенного вещества в конечном объеме более разбавленного раствора, а затем расчета объема исходного раствора, который содержит это количество растворенного вещества. Помните, что разбавление данного количества основного раствора растворителем не приводит к изменению числа , а не количества молей присутствующего растворенного вещества. Таким образом, соотношение между объемом и концентрацией основного раствора и объемом и концентрацией желаемого разбавленного раствора составляет
\ ((V_s) (M_s) = моли \: of \: solute = (V_d) (M_d) \ tag {12.1.2} \)
, где нижние индексы s и d обозначают исходный и разбавленный растворы соответственно. Пример 5 демонстрирует расчеты, связанные с разбавлением концентрированного исходного раствора.
Рисунок 12.1.3 Приготовление раствора известной концентрации путем разбавления исходного раствора (a) Объем ( V s ), содержащий желаемые моли растворенного вещества (M s ), измеряют из исходного раствора. раствор известной концентрации.(b) Отмеренный объем исходного раствора переносят во вторую мерную колбу. (c) Измеренный объем во второй колбе затем разбавляется растворителем до объемной отметки [( V s ) (M s ) = ( V d ) (M d ). ].
Пример 12.1.3
Какой объем 3,00 М исходного раствора глюкозы необходим для приготовления 2500 мл раствора D5W в Примере 4?
Дано: Объем и молярность разбавленного раствора
Запрошено: объем основного раствора
Стратегия:
A Рассчитайте количество молей глюкозы в указанном объеме разбавленного раствора, умножив объем раствора на его молярность.
B Чтобы определить необходимый объем исходного раствора, разделите количество молей глюкозы на молярность исходного раствора.
Решение:
A Раствор D5W в Примере 4 содержал 0,310 М глюкозы. Начнем с использования уравнения 12.1.2 для расчета количества молей глюкозы, содержащихся в 2500 мл раствора:
\ (моль \: глюкоза = 2500 \: \ cancel {mL} \ left (\ dfrac {1 \: \ cancel {L}} {1000 \: \ cancel {mL}} \ right) \ left (\ dfrac { 0.310 \: моль \: глюкоза} {1 \: \ cancel {L}} \ right) = 0,775 \: моль \: глюкоза \)
B Теперь мы должны определить объем исходного раствора 3,00 M, который содержит это количество глюкозы:
\ (объем \: of \: stock \: soln = 0,775 \: \ cancel {mol \: gluosis} \ left (\ dfrac {1 \: L} {3 .00 \: \ cancel {mol \: глюкоза}} \ right) = 0,258 \: L \: или \: 258 \: mL \)
При определении необходимого объема исходного раствора мы должны были разделить желаемое количество молей глюкозы на концентрацию исходного раствора, чтобы получить соответствующие единицы.Кроме того, количество молей растворенного вещества в 258 мл исходного раствора такое же, как количество молей в 2500 мл более разбавленного раствора; изменилось только количество растворителя . Полученный ответ имеет смысл: разбавление основного раствора примерно в 10 раз увеличивает его объем примерно в 10 раз (258 мл → 2500 мл). Следовательно, концентрация растворенного вещества должна уменьшиться примерно в 10 раз, как это происходит (3,00 M → 0,310 M).
Мы также могли решить эту проблему за один шаг, решив уравнение 12.1,2 для В с и подставив соответствующие значения:
\ (V_s = \ dfrac {(V_d) (M_d)} {M_s} = \ dfrac {(2 .500 \: L) (0,310 \: \ cancel {M})} {3 .00 \: \ отменить {M}} = 0,258 \: L \)
Как мы уже отмечали, часто существует несколько правильных способов решения проблемы.
Упражнение
Какой объем 5,0 М маточного раствора NaCl необходим для приготовления 500 мл физиологического раствора (0,16 М NaCl)?
Ответ: 16 мл
Концентрации ионов в растворе
В разделе 9. {2-} (водн.) \ Tag {12.1.2} \)
Таким образом, 1 моль единиц формулы дихромата аммония растворяется в воде с образованием 1 моль анионов Cr 2 O 7 2- и 2 моль катионов NH 4 + (см. Рисунок 12.1.4).
Рисунок 12.1.4 Растворение 1 моля ионного соединения В этом случае растворение 1 моля (NH 4 ) 2 Cr 2 O 7 дает раствор, содержащий 1 моль Cr 2 O 7 2- ионов и 2 моль NH 4 + ионов.(Молекулы воды для ясности не показаны с молекулярной точки зрения.)
Когда мы проводим химическую реакцию с использованием раствора соли, например дихромата аммония, нам необходимо знать концентрацию каждого иона, присутствующего в растворе. Если раствор содержит 1,43 M (NH 4 ) 2 Cr 2 O 7 , то концентрация Cr 2 O 7 2- также должна быть 1,43 M, потому что существует один Cr 2 O 7 2- ионов на формульную единицу.Однако на формульную единицу приходится два иона NH 4 + , поэтому концентрация ионов NH 4 + составляет 2 × 1,43 M = 2,86 М. Поскольку каждая формульная единица (NH 4 ) 2 Cr 2 O 7 при растворении в воде образует три иона (2NH 4 + + 1Cr 2 O 7 2-), общая концентрация ионов в решение 3 × 1,43 M = 4,29 M.
Пример 12.1,4
Каковы концентрации всех веществ, полученных из растворенных веществ, в этих водных растворах?
- 0,21 М NaOH
- 3,7 M (CH 3 ) CHOH
- 0,032 M In (NO 3 ) 3
Дано: молярность
Запрошено: концентрации
Стратегия:
A Классифицируйте каждое соединение как сильный электролит или как неэлектролит. — (водн.) \)
B Поскольку каждая формульная единица NaOH производит один ион Na + и один ион OH — , концентрация каждого иона такая же, как концентрация NaOH: [Na + ] = 0.21 M и [OH — ] = 0,21 M.
A Формула (CH 3 ) 2 CHOH представляет собой 2-пропанол (изопропиловый спирт) и содержит группу –OH, поэтому это спирт. Напомним из раздела 9.1, что спирты — это ковалентные соединения, которые растворяются в воде с образованием растворов нейтральных молекул. Таким образом, спирты не являются электролитами.
B Таким образом, единственными растворенными веществами в растворе являются (CH 3 ) 2 молекул CHOH, поэтому [(CH 3 ) 2 CHOH] = 3.- (водн.) \)
B Одна формульная единица In (NO 3 ) 3 дает один ион In 3 + и три иона NO 3 —, поэтому 0,032 M In (NO 3 ) 3 раствор содержит 0,032 M In 3 + и 3 × 0,032 M = 0,096 M NO 3 — , то есть [In 3 + ] = 0,032 M и [NO 3 — ] = 0,096 М.
Упражнение
Каковы концентрации всех веществ, полученных из растворенных веществ, в этих водных растворах?
- 0.0012 M Ba (OH) 2
- 0,17 M Na 2 SO 4
- 0,50 M (CH 3 ) 2 CO, широко известный как ацетон
Ответ:
- [Ba 2 + ] = 0,0012 М; [OH — ] = 0,0024 M
- [Na + ] = 0,34 М; [SO 4 2−] = 0,17 M
- [(CH 3 ) 2 CO] = 0,50 M
Ключевые уравнения
соотношение между объемом и концентрацией основного и разбавленного растворов
Уравнение 12.1.2: \ ((V_s) (M_s) = моль \: of \: solute = (V_d) (M_d) \)
Сводка
Концентрация вещества — это количество растворенного вещества, присутствующего в данном количестве раствора. Концентрации обычно выражаются как молярность , количество молей растворенного вещества в 1 л раствора. Растворы известной концентрации могут быть приготовлены либо путем растворения известной массы растворенного вещества в растворителе и разбавления до желаемого конечного объема, либо путем разбавления соответствующего объема более концентрированного раствора (исходный раствор ) до желаемого конечного объема.
Ключевые вынос
- Концентрации раствора обычно выражаются в виде молярности и могут быть получены путем растворения известной массы растворенного вещества в растворителе или разбавления исходного раствора.
Концептуальные проблемы
Какое из представлений лучше всего соответствует 1 М водному раствору каждого соединения? Обоснуйте свои ответы.
- NH 3
- HF
- CH 3 CH 2 CH 2 OH
Na 2 SO 4
Какое из представлений, показанных в задаче 1, лучше всего соответствует 1 М водному раствору каждого соединения? Обоснуйте свои ответы.
- CH 3 CO 2 H
- NaCl
- Na 2 S
- Na 3 PO 4
- ацетальдегид
Ожидаете ли вы, что 1,0 М раствор CaCl 2 будет лучше проводить электричество, чем 1,0 М раствор NaCl? Почему или почему нет?
Альтернативный способ определения концентрации раствора — моляльность , сокращенно м .Моляльность определяется как количество молей растворенного вещества в 1 кг растворителя . Чем это отличается от молярности? Ожидаете ли вы, что 1 M раствор сахарозы будет более или менее концентрированным, чем 1 m раствор сахарозы? Поясните свой ответ.
Каковы преимущества использования решений для количественных расчетов?
Ответ
Если количество вещества, необходимое для реакции, слишком мало для точного взвешивания, использование раствора вещества, в котором растворенное вещество диспергировано в гораздо большей массе растворителя, позволяет химикам измерить количество вещества. вещество, точнее.
Числовые задачи
Рассчитайте количество граммов растворенного вещества в 1.000 л каждого раствора.
- 0,2593 M NaBrO 3
- 1,592 М ННО 3
- 1,559 М уксусная кислота
- 0,943 M йодат калия
Рассчитайте количество граммов растворенного вещества в 1.000 л каждого раствора.
- 0.1065 Мбай 2
- 1,135 M Na 2 SO 4
- 1,428 M NH 4 Br
- 0,889 М ацетат натрия
Если все растворы содержат одно и то же растворенное вещество, какой раствор содержит большую массу растворенного вещества?
- 1,40 л 0,334 М раствора или 1,10 л 0,420 М раствора
- 25,0 мл 0,134 М раствора или 10,0 мл 0,295 М раствора
- 250 мл 0.489 М раствор или 150 мл 0,769 М раствора
Заполните следующую таблицу для 500 мл раствора.
Соединение Масса (г) Моль Концентрация (м) сульфат кальция 4,86 уксусная кислота 3.62 дигидрат иодистого водорода 1,273 бромид бария 3,92 глюкоза 0,983 ацетат натрия 2.42 Какая концентрация каждого вида присутствует в следующих водных растворах?
- 0,489 моль NiSO 4 в 600 мл раствора
- 1,045 моль бромида магния в 500 мл раствора
- 0,146 моль глюкозы в 800 мл раствора
- 0,479 моль CeCl 3 в 700 мл раствора
Какая концентрация каждого вида присутствует в следующих водных растворах?
- 0.324 моль K 2 MoO 4 в 250 мл раствора
- 0,528 моль формиата калия в 300 мл раствора
- 0,477 моль KClO 3 в 900 мл раствора
- 0,378 моль йодида калия в 750 мл раствора
Какова молярная концентрация каждого раствора?
- 8,7 г бромида кальция в 250 мл раствора
- 9,8 г сульфата лития в 300 мл раствора
- 12.4 г сахарозы (C 12 H 22 O 11 ) в 750 мл раствора
- 14,2 г гексагидрата нитрата железа (III) в 300 мл раствора
Какова молярная концентрация каждого раствора?
- 12,8 г гидросульфата натрия в 400 мл раствора
- 7,5 г гидрофосфата калия в 250 мл раствора
- 11,4 г хлорида бария в 350 мл раствора
- 4.3 г винной кислоты (C 4 H 6 O 6 ) в 250 мл раствора
Приведите концентрацию каждого реагента в следующих уравнениях, принимая 20,0 г каждого реагента и объем раствора 250 мл для каждого реагента.
- BaCl 2 (водн.) + Na 2 SO 4 (водн.) →
- Ca (OH) 2 (водн.) + H 3 PO 4 (водн.) →
- Al (NO 3 ) 3 (водн.) + H 2 SO 4 (водн.) →
- Pb (NO 3 ) 2 (водн.) + CuSO 4 (водн.) →
- Al (CH 3 CO 2 ) 3 (водн.) + NaOH (водн.) →
На эксперимент потребовалось 200.0 мл 0,330 М раствора Na 2 CrO 4 . Для приготовления этого раствора использовали исходный раствор Na 2 CrO 4 , содержащий 20,0% растворенного вещества по массе с плотностью 1,19 г / см 3 . Опишите, как приготовить 200,0 мл 0,330 М раствора Na 2 CrO 4 с использованием исходного раствора.
Гипохлорит кальция [Ca (OCl) 2 ] — эффективное дезинфицирующее средство для одежды и постельного белья.Если в растворе концентрация Ca (OCl) 2 составляет 3,4 г на 100 мл раствора, какова молярность гипохлорита?
Фенол (C 6 H 5 OH) часто используется в качестве антисептика в жидкостях для полоскания рта и пастилках для горла. Если в жидкости для полоскания рта концентрация фенола составляет 1,5 г на 100 мл раствора, какова молярность фенола?
Если таблетка, содержащая 100 мг кофеина (C 8 H 10 N 4 O 2 ), растворяется в воде с получением 10.0 унций раствора, какова молярная концентрация кофеина в растворе?
На этикетке с определенным лекарством есть инструкция по добавлению 10,0 мл стерильной воды, в которой указано, что каждый миллилитр полученного раствора будет содержать 0,500 г лекарства. Если пациенту назначена доза 900,0 мг, сколько миллилитров раствора следует ввести?
ответы
1.74 × 10 −3 M кофеин
Авторы
Изменено Джошуа Халперн, Скотт Синекс и Скотт Джонсон
2.5: Приготовление растворов — Химия LibreTexts
Приготовление раствора известной концентрации, возможно, является наиболее распространенным видом деятельности в любой аналитической лаборатории. Метод измерения растворенного вещества и растворителя зависит от желаемой концентрации и от того, насколько точно должна быть известна концентрация раствора.Пипетки и мерные колбы используются, когда нам нужно знать точную концентрацию раствора; градуированных цилиндров, стаканов и / или бутылок с реагентами достаточно, когда концентрации должны быть приблизительными. В этом разделе описаны два метода приготовления растворов.
Подготовка исходных растворов
Исходный раствор готовят путем взвешивания соответствующей порции чистого твердого вещества или путем измерения соответствующего объема чистой жидкости, помещения ее в подходящую колбу и разбавления до известного объема.От желаемой единицы концентрации зависит точное количество реагента. Например, чтобы приготовить раствор с известной молярностью, вы взвешиваете подходящую массу реагента, растворяете ее в части растворителя и доводите до желаемого объема. Чтобы приготовить раствор, в котором концентрация растворенного вещества составляет процент по объему, вы отмеряете соответствующий объем растворенного вещества и добавляете достаточное количество растворителя для получения желаемого общего объема.
Пример \ (\ PageIndex {1} \)
Опишите, как приготовить следующие три раствора: (a) 500 мл приблизительно 0.20 М NaOH с использованием твердого NaOH; (b) 1 л 150,0 ppm Cu 2 + с использованием металлической Cu; и (c) 2 л 4% об. уксусной кислоты с использованием концентрированной ледяной уксусной кислоты (99,8% мас. / мас. уксусной кислоты).
Решение
(a) Поскольку желаемая концентрация известна с двумя значащими цифрами, нам не нужно точно измерять массу NaOH или объем раствора. Желаемая масса NaOH
\ [\ frac {0.20 \ text {моль NaOH}} {\ text {L}} \ times \ frac {40.0 \ text {г NaOH}} {\ text {моль NaOH}} \ times 0.50 \ text {L} = 4.0 \ text {г NaOH} \ nonumber \]
Чтобы приготовить раствор, поместите 4,0 грамма NaOH, взвешенного с точностью до десятых долей грамма, в бутылку или химический стакан и добавьте примерно 500 мл воды.
(b) Поскольку желаемая концентрация Cu 2 + дается с четырьмя значащими цифрами, мы должны точно измерить массу металлической Cu и конечный объем раствора. Желаемая масса металлической меди
\ [\ frac {150.0 \ text {mg Cu}} {\ text {L}} \ times 1.000 \ text {M} \ times \ frac {1 \ text {g}} {1000 \ text {mg}} = 0.1500 \ text {g Cu } \ nonumber \]
Чтобы приготовить раствор, отмерьте точно 0,1500 г Cu в небольшой химический стакан и растворите его, используя небольшую порцию концентрированной HNO. 3 . Для обеспечения полного переноса Cu 2 + из химического стакана в мерную колбу — то, что мы называем количественным переносом — промойте химический стакан несколько раз небольшими порциями воды, добавляя каждое полоскание в мерную колбу. .Наконец, добавьте воды до калибровочной отметки мерной колбы.
(c) Концентрация этого раствора является приблизительной, поэтому нет необходимости точно измерять объемы, а также нет необходимости учитывать тот факт, что ледяная уксусная кислота немного меньше, чем 100% мас. / Мас. Уксусной кислоты (это приблизительно 99,8% мас. / мас.). Необходимый объем ледяной уксусной кислоты —
\ [\ frac {4 \ text {mL} \ ce {Ch4COOH}} {100 \ text {mL}} \ times 2000 \ text {mL} = 80 \ text {mL} \ ce {Ch4COOH} \ nonumber \]
Чтобы приготовить раствор, с помощью градуированного цилиндра перенесите 80 мл ледяной уксусной кислоты в емкость, которая вмещает приблизительно 2 л, и добавьте воды, достаточной для доведения раствора до желаемого объема.
Упражнение \ (\ PageIndex {1} \)
Предоставьте инструкции по приготовлению 500 мл 0,1250 M KBrO 3 .
- Ответ
Для приготовления 500 мл 0,1250 M KBrO 3 требуется
\ [0.5000 \ text {L} \ times \ frac {0.1250 \ text {mol} \ ce {KBrO3}} {\ text {L}} \ times \ frac {167.00 \ text {g} \ ce {KBrO3}} {\ text {mol} \ ce {KBrO3}} = 10,44 \ text {g} \ ce {KBrO3} \ nonumber \]
Поскольку у концентрации есть четыре значащих цифры, мы должны приготовить раствор, используя мерную стеклянную посуду.Поместите образец KBrO 3 10,44 г в мерную колбу на 500 мл и частично заполните водой. Вихревым движением растворить KBrO 3 , а затем разбавить водой до калибровочной отметки на колбе.
Приготовление растворов разбавлением
Растворы часто готовят путем разбавления более концентрированного исходного раствора. Известный объем основного раствора переносят в новый контейнер и доводят до нового объема. Поскольку общее количество растворенного вещества одинаково до и после разбавления, мы знаем, что
\ [C_o \ times V_o = C_d \ times V_d \ label {2.1} \]
где \ (C_o \) — концентрация исходного раствора, \ (V_o \) — объем разбавляемого исходного раствора, \ (C_d \) — концентрация разбавленного раствора, а \ (V_d \) — объем разбавленного раствора. решение. Опять же, тип посуды, используемой для измерения \ (V_o \) и \ (V_d \), зависит от того, насколько точно нам нужно знать концентрацию раствора.
Обратите внимание, что уравнение \ ref {2.1} применимо только к тем единицам концентрации, которые выражены в единицах объема раствора, включая молярность, формальность, нормальность, объемный процент и процентное отношение массы к объему.Это также относится к массовым процентам, миллионным и миллионным долям, если плотность раствора составляет 1,00 г / мл. Мы не можем использовать уравнение \ ref {2.1}, если выражаем концентрацию через молярность, поскольку она основана на массе растворителя, а не на объеме раствора. См. Rodríquez-López, M .; Carrasquillo, A. J. Chem. Educ. 2005 , 82 , 1327-1328 для дальнейшего обсуждения.
Пример \ (\ PageIndex {2} \)
Лабораторная процедура требует 250 мл приблизительно 0.10 М раствор NH 3 . Опишите, как вы приготовили бы этот раствор, используя исходный раствор концентрированного NH 3 (14,8 M).
Решение
Подстановка известных объемов в уравнение \ ref {2.1}
\ [14,8 \ text {M} \ times V_o = 0,10 \ text {M} \ times 250 \ text {mL} \ nonumber \]
и решение для \ (V_o \) дает 1,7 мл. Поскольку мы делаем раствор, который составляет приблизительно 0,10 M NH 3 , мы можем использовать градуированный цилиндр для измерения 1.7 мл концентрированного NH 3 , перенесите NH 3 в стакан и добавьте воды, чтобы получить общий объем приблизительно 250 мл.
Хотя обычно мы выражаем молярность как моль / л, мы можем выразить объемы в мл, если сделаем это как для \ (V_o \) , так и для \ (V_d \).
Упражнение \ (\ PageIndex {2} \)
Для приготовления стандартного раствора Zn 2 + необходимо растворить 1,004 г образец цинковой проволоки в минимальном количестве HCl и довести до объема в мерной колбе на 500 мл.{2+}}} {\ text {mL}} \ times 2.000 \ text {mL} = C_d \ times 250.0 \ text {mL} \ nonumber \]
, где C d — стандартная концентрация раствора. Растворение дает концентрацию 16,06 мкг Zn 2 + / мл.
Как показано в следующем примере, мы можем использовать уравнение \ ref {2.1} для расчета исходной концентрации раствора, используя его известную концентрацию после разбавления.
Пример \ (\ PageIndex {3} \)
Образец руды был проанализирован на Cu 2 + следующим образом.Пробу руды весом 1,25 г растворяли в кислоте и доводили до объема в мерной колбе на 250 мл. Порцию полученного раствора 20 мл переносили пипеткой в мерную колбу на 50 мл и доводили до объема. Анализ этого раствора дает концентрацию Cu 2 + как 4,62 мкг / мл. Каков массовый процент Cu в исходной руде?
Решение
Подстановка известных объемов (со значащими цифрами, соответствующими пипеткам и мерным колбам) в уравнение \ ref {2.{2+}} \ nonumber \]
Подготовка растворов
Подготовка решений
Растворы обычно готовятся в лаборатории из твердых материалов, жидкостей или других растворов. Приведенные ниже описания предполагают знание расчетов, необходимых для определения концентраций раствора, способность точно взвешивать твердые частицы и пипетировать жидкости.
Из твердого материала
| (1) | Определите концентрацию и количество раствора, необходимые для эксперимента. |
| (2) | Рассчитайте количество растворенного вещества, необходимое для приготовления желаемого раствора. |
| (3) | Взвесьте количество растворенного вещества, рассчитанное на этапе (2), и получите мерную колбу соответствующего объема. |
| (4) | Добавьте растворенное вещество в мерную колбу. |
| (5) | Заполните мерную колбу примерно на две трети, закройте пробкой и перемешайте. Для этого переверните колбу, встряхните и верните колбу в вертикальное положение.Сделайте это десять раз. Обязательно удерживайте пробку в колбе. |
| (6) | Осторожно наполните колбу до отметки, нанесенной на горлышко колбы. При необходимости используйте промывочную бутылку или капельницу для лекарств. |
| (7) | Тщательно перемешайте раствор, плотно закрыв колбу и перевернув ее десять-двенадцать раз. |
Из жидкости или другого раствора
| (1) | Определите концентрацию и количество раствора, необходимые для эксперимента. |
| (2) | Рассчитайте количество исходного раствора или жидкости, необходимое для приготовления желаемого раствора (маточный раствор — это раствор с известной концентрацией, большей, чем у раствора, который вы готовите). |
| (3) | Используйте пипетку для измерения количества раствора или жидкости, рассчитанного на шаге (2). |
| (4) | Добавьте раствор или жидкость в мерную колбу соответствующего объема. |
| (5) | Заполните мерную колбу примерно на две трети и перемешайте. |
| (6) | Осторожно наполните колбу до отметки, нанесенной на горлышко колбы. При необходимости используйте промывочную бутылку или капельницу для лекарств. |
| (7) | Тщательно перемешайте раствор, плотно закрыв колбу и перевернув ее десять-двенадцать раз. |
Подготовка растворов | Химия для неосновных
Цели обучения
- Опишите процесс приготовления растворов.
Сколько воды мне добавить?
Передняя обложка кулинарной книги Crisco 1912 года, любезно предоставлено Викимедиа.
Еще в «старые добрые времена» (когда бы это ни было на самом деле) многие повара не беспокоились о точных измерениях. Они «просто знали», сколько муки использовать или сколько добавить воды. Большинству из нас нужны более точные способы измерения, когда мы готовим. Химики очень осторожны при приготовлении растворов, поскольку результаты их экспериментов должны быть количественными. «Просто знать» недостаточно для научных целей.
Подготовка растворов
Если вы пытаетесь приготовить 1,00 л 1,00 раствора NaCl, вы получите 58,44 г хлорида натрия. Однако нельзя просто добавить хлорид натрия в 1,00 л воды. После растворения растворенного вещества объем раствора будет немного больше литра, потому что гидратированные ионы натрия и хлора занимают место в растворе. Вместо этого необходимо использовать мерную колбу . Мерные колбы бывают разных размеров (см. Изображение ниже) и предназначены для того, чтобы химик мог приготовить раствор только одного определенного объема.
Другими словами, вы не можете использовать мерную колбу объемом 1 литр для приготовления 500 мл раствора. Его можно использовать только для приготовления 1 литра раствора. Действия, которые необходимо выполнить при приготовлении раствора с использованием мерной колбы объемом 1 л, изложены ниже и показаны на рисунке ниже.
- Отвешивают соответствующую массу растворенного вещества и добавляют в мерную колбу, которая примерно наполовину заполнена дистиллированной водой.
- Раствор перемешивают до полного растворения растворенного вещества.
- Осторожно доливают дистиллированную воду до отметки на горлышке колбы.
- Колбу закрывают крышкой и несколько раз переворачивают до полного перемешивания.
Рис. 1. Действия, которые необходимо выполнить при приготовлении раствора известной молярности: (A) взвесить правильную массу растворенного вещества, (B) раствориться в растворителе в мерной колбе, и (C) добавить растворитель к линии заполнения на колбе и смешивание. От фонда CK-12 — Кристофер Ауён.
Сводка
- Описаны этапы приготовления раствора.
Практика
Посмотрите видео по ссылке ниже и ответьте на следующие вопросы:
- Какое решение?
- Что такое растворенное вещество?
- Что такое растворитель?
- Какие меры предосторожности необходимо соблюдать?
Обзор
- Почему вы добавляете растворенное вещество в колбу, только частично заполненную растворителем?
- Сколько растворителя добавить в конце?
- Почему вы переворачиваете колбу несколько раз после разбавления до метки?
Глоссарий
- мерная колба: Калиброванная колба с длинным горлышком для точного приготовления растворов.
Подготовка растворов
Подготовка растворов
Растворы можно приготовить двумя способами: из чистого растворенного вещества и из другого раствора.
Первый метод включает измерение количества чистого растворенного вещества. Примером этого может быть раствор сахарозы, описанный ранее в этом модуле. Если вы помните, взвешивали 21,7 грамма чистой сахарозы, а затем добавляли воду до тех пор, пока общий объем раствора не достиг 500 мл.Концентрация этого раствора составляла 0,127 М.
.
Аналогичный раствор можно приготовить вторым методом. Предположим, вам доступен 1,0 М раствор сахарозы вместо чистой твердой сахарозы. При использовании этого метода важно понимать, что добавление воды к раствору не изменяет количество молей растворенного вещества, которое присутствует. Поскольку при этом увеличивается общий объем раствора, концентрация будет уменьшаться (поскольку концентрация выражается в молях растворенного вещества на литр раствора).Например, если вы возьмете один литр 1,0 М раствора сахарозы и добавите воду до тех пор, пока общий объем не станет равным двум литрам, полученный раствор все равно будет содержать один моль сахарозы. Однако, поскольку объем раствора увеличился до двух литров, концентрация теперь будет 0,50 М. Это можно выразить математически:
Наведите указатель мыши на части уравнения, начиная с левого края. |
Этот пример показывает, что количество молей, взятых из исходного раствора, должно быть равно количеству молей в новом растворе.Количество молей растворенного вещества, содержащегося в любом растворе, можно рассчитать, умножив молярность на объем (в литрах):
Так как количество молей, взятых из исходного раствора, должно быть равно количеству молей в новом растворе,
Если исходный раствор называется концентрированным раствором (или концом), а новый раствор называется разбавлением (или разбавлением), то приведенное выше выражение может быть записано как
Если
вы хотели приготовить 500 мл раствора сахарозы, аналогичного раствору
приготовленные ранее (концентрация = 0.127 М), какой объем 1.0 М
Вы бы использовали раствор сахарозы?
Руководство по приготовлению раствора
| Carolina.com
Carolina предлагает много типов готовых решений, но некоторые учителя предпочитают создавать свои собственные. Если это вас интересует, продолжайте читать. Это краткое руководство предоставит вам информацию, необходимую для создания ряда решений, обычно используемых в учебных лабораториях.
Давайте рассмотрим некоторые соображения безопасности:
- Всегда используйте соответствующие средства индивидуальной защиты (СИЗ) при работе с химическими веществами и приготовлении растворов.Используйте это руководство, чтобы выбрать СИЗ, подходящие для ваших нужд.
- Перед использованием дважды прочтите этикетку на химическом веществе. Прочтите его, когда возьмете химикат с полки, и еще раз перед тем, как удалить какое-либо химическое вещество из бутылки.
- При использовании концентрированных химикатов для приготовления растворов убедитесь, что вы медленно добавляете более концентрированный раствор к менее концентрированному. Обратный порядок действий может привести к закипанию и разбрызгиванию раствора.
Приготовление раствора
Молярные растворы
Молярность (M) означает количество молей растворенного вещества на литр раствора.Чтобы приготовить 1 М раствор, медленно добавьте 1 формульную массу соединения в чистую мерную колбу объемом 1 л, наполовину заполненную дистиллированной или деионизированной водой. Дайте составу полностью раствориться, при необходимости осторожно покачивая колбу. Когда растворенное вещество полностью растворится и раствор достигнет комнатной температуры, разбавьте водой до метки. Вставьте пробку и, положив большой палец на пробку и положив руку на горлышко колбы,. переверните колбу несколько раз, чтобы перемешать. Вот пара примеров использования этого метода:
Чтобы приготовить 1 М раствор гидроксида натрия, медленно добавьте 40 г гидроксида натрия к 500 мл дистиллированной или деионизированной воды в мерной колбе объемом 1 л.Когда твердые вещества полностью растворятся и раствор достигнет комнатной температуры, разбавьте до метки, вставьте и закрепите пробку большим пальцем, а затем несколько раз переверните колбу для перемешивания.
Чтобы приготовить 1 М раствор уксусной кислоты, растворите 60,05 г уксусной кислоты в 500 мл дистиллированной или деионизированной воды в мерной колбе объемом 1 л. Поскольку уксусная кислота является жидкостью, ее можно также измерить по объему. Разделите массу кислоты на ее плотность (1,049 г / мл), чтобы определить объем (57.24 мл). Для приготовления раствора используйте 60,05 г или 57,24 мл уксусной кислоты. Осторожно покрутите колбу, чтобы перемешать раствор. Когда раствор достигнет комнатной температуры, разбавьте его до отметки, вставьте и зафиксируйте пробку большим пальцем и несколько раз переверните колбу для перемешивания.
Разведения
При приготовлении разведения определите требуемый объем и молярную концентрацию полученного раствора. Используйте следующее уравнение, чтобы определить, сколько концентрированного реагента необходимо для приготовления разбавленного раствора,
M реагент × V реагент = M разбавление × V разбавление
, где M — молярность, а V — объем.
Медленно добавьте рассчитанный объем концентрированного реагента в мерную колбу надлежащего размера, наполовину заполненную дистиллированной или деионизированной водой, и встряхните колбу для перемешивания. Как только раствор достигнет комнатной температуры, разбавьте его водой до метки, вставьте и закройте пробку и несколько раз переверните колбу для перемешивания.
Например, какой объем 10 М уксусной кислоты требуется для приготовления 1,0 л 0,50 М уксусной кислоты?
10 M × V реагент = 0.50 M × 1,0 л
V реагент = 0,050 л = 50 мл
Объем 50 мл 10 М уксусной кислоты требуется для приготовления 1,0 л 0,50 М уксусной кислоты.
Рецепты общих растворов
Для приготовления этих растворов медленно добавьте необходимые ингредиенты в мерную колбу объемом 1 л, наполовину заполненную дистиллированной или деионизированной водой. Дайте ингредиентам полностью раствориться, при необходимости осторожно покачивая колбу. Когда растворенное вещество полностью растворится и раствор достигнет комнатной температуры, разбавьте водой до метки.Вставьте и зафиксируйте пробку и несколько раз переверните колбу для перемешивания.
Каждый реагент в следующей таблице связан с нашим онлайн-каталогом для получения дополнительной информации и удобной покупки. Для жидкостей мы ссылались на размер 500 мл реагента или химиката ACS, упакованного в защитную бутылку с пластиковым покрытием. Для гидроксида натрия мы указали размер химического реагента класса чистоты 500 г. Могут быть доступны другие размеры и сорта. Пожалуйста, обратитесь к нашим каталогам для получения дополнительной информации.
Решите ли вы создавать собственные решения или покупать их у нас в готовом виде, в Carolina вы найдете все, что вам нужно.
Загрузить руководство по подготовке решения
Магазин химикатов
Как приготовить раствор правильной концентрации
Обзор:
Когда они находятся в химической лаборатории или просто пишут тест, многие студенты борются с тем, как создать раствор известной концентрации. Студентам это сложно, потому что они пытаются вычислить раствор в молях, а это единица измерения, которую невозможно измерить в лаборатории.Есть несколько простых шагов по приготовлению подходящего раствора с известной концентрацией.
Шаг 1. Определение количества молей соединения
Первый шаг — определить, какую концентрацию раствора вам нужно приготовить вместе с желаемым объемом. В этом примере мы собираемся приготовить 1234 мл 1,54-молярного раствора NaCl (хлорид натрия).
Сначала мы определим количество молей NaCl, содержащихся в 1234 мл 1.54 молярный раствор. Для этого воспользуемся следующей формулой:
Где:
n = количество молей раствора в молях
C = концентрация раствора в моль / л
V = объем раствора в л
ПРИМЕЧАНИЕ: Всегда проверяйте соответствие единиц измерения.
Обратите внимание, что единицей объема является мл, а единицей измерения C — моль / л. Это означает, что перед решением уравнения нам нужно преобразовать мл в L. 1234 мл равно 1.234 л. Теперь, когда все наши единицы согласованы, мы можем заменить наши известные значения концентрации и объема:
Шаг 2: Определение массы соединения
Теперь мы знаем, что нам нужно добавить в наш раствор 1,90 моль NaCl; однако моль — это не единица, которую можно измерить с помощью обычных лабораторных инструментов. Сначала мы должны преобразовать его в единицы, которые легко измерить в лаборатории. Для этого требуется новое уравнение:
Где:
n = количество молей в молях
m = граммы соединения в г
M = молярная масса соединения в г / моль (взято непосредственно из периодической таблицы)
Чтобы определить M, нам нужно поближе взглянуть на наше соединение:
NaCl = 1 Na + 1 Cl
= (1 * 22.99 г / моль) + (1 * 35,45 г / моль)
= 58,44 г / моль
Мы определили нашу молярную массу (M) и вычислили n на шаге 1. Теперь мы готовы использовать замену, чтобы найти m. Поскольку все наши единицы согласованы, никаких дополнительных настроек не требуется.
м = n * M
Теперь мы знаем, что нам нужно отмерить 111,0 граммов NaCl на весах, чтобы добавить его в раствор.
ПРИМЕЧАНИЕ: Ключевым моментом при создании любого раствора является медленное добавление соединения к воде при перемешивании.Это начнется с очень низкой концентрации соединения и будет постепенно увеличиваться до желаемой концентрации. Если вместо этого к соединению добавить воду, это начнется с очень высокой концентрации раствора, что потенциально может привести к образованию опасного соединения.
Заполните химический стакан примерно на деионизированной водой, затем добавьте 111,0 г NaCl. После добавления NaCl заполните контейнер до отметки 1,234 л. Теперь у вас есть 1,234 л 1,54-молярного раствора NaCl.


