Как сделать раствор для: глиняный, состав, пропорции, как сделать, приготовить своими руками, каким штукатурить печные трубы, видео-инструкция, фото и цена
- глиняный, состав, пропорции, как сделать, приготовить своими руками, каким штукатурить печные трубы, видео-инструкция, фото и цена
- Как сделать цветной раствор для кладки кирпича
- Как сделать раствор для штукатурки стен своими руками. Приготовление штукатурного раствора для стен
- Как сделать огнеупорный раствор для печи который не треснет
- как приготовить смесь, глиняный состав, пропорции для оштукатуривания, соотношение глины и песка, как сделать
- состав и пропорции, как приготовить смесь своими руками, соотношение глины и песка для оштукатуривания
- Как приготовить раствор для линз в домашних условиях?
- Подготовка растворов
- Как приготовить раствор из маточного раствора
- Приготовление растворов в лаборатории | Общие лабораторные методы
- Как приготовить раствор моющего средства
- Глава 7 – Растворы – Химия
- Создание стандартного раствора из другого раствора: разбавление
- Chem4Kids.com: Материя: Решения
глиняный, состав, пропорции, как сделать, приготовить своими руками, каким штукатурить печные трубы, видео-инструкция, фото и цена
Вот и наступили времена, когда традиционные печи стали казаться дремучим пережитком прошлого, ведь, тотальная газификация частного жилья практически вытеснила альтернативное топливо. За долгие годы они практически не претерпели особых изменений в отделке, так как новые материалы фактически не разрабатывались.
На фото – проведение оштукатуривания печи
Это, конечно, напрасно, так как печь – достаточно надежный источник тепла, который не страдает от перебоев подачи газа, электроэнергии, дизтоплива или пеллет. Достаточно просто сделать своевременный запас дров и угля, так что услуги печников, скорее всего, снова будут в цене. В статье ниже мы попытаемся раскрыть один из секретов, каким должен быть раствор для оштукатуривания печей.
Этот вопрос неизбежно возникнет при сооружении нового или ремонте старого отопительного прибора. Согласитесь, условия у отделки будут сродни экстремальным, так как ей придется периодически очень сильно нагреваться, а затем остывать. Выдержать это сможет далеко не каждая даже современная смесь.
Согласитесь, условия у отделки будут сродни экстремальным, так как ей придется периодически очень сильно нагреваться, а затем остывать. Выдержать это сможет далеко не каждая даже современная смесь.
Современные технологии
Кроме того, не стоит упускать из виду экологичность штукатурки, чтобы в комнату не попадали при нагреве токсичные вещества. Также она должна быть эластичной и иметь хорошую теплопроводность. Цена готовой смеси очень и очень низкая.
Зачем штукатурить печь
Вопрос далеко непраздный, так как при изготовлении стараются сделать ее прочной и герметичной.
И, все-таки, встретить неоштукатуренную печь практически нереально, почему:
- Использование отделочного материала позволит украсить интерьер помещения и облагородить внешний вид сооружения.
- Глиняный раствор для штукатурки печи, используемый в виде штукатурки, является страховочным слоем, которые позволяет сделать печную кладку прочнее и герметичней. Связано это с объективными причинами.
 Так как перепады температуры кладка трескается, что может стать причиной попадания дыма в помещение. Это является негативным фактором не только для интерьера, но и для здоровья.
Так как перепады температуры кладка трескается, что может стать причиной попадания дыма в помещение. Это является негативным фактором не только для интерьера, но и для здоровья.
Если посмотреть на полки строительных магазинов, цена многих термостойких современных материалов превосходит традиционно применяемые смеси для оштукатуривания печей на основе глины.
Например, использовать можно глинопесчаный раствор с добавлением извести или цемента, подходит также раствор из извести и гипса. Но, чаще всего стараются применять смеси на основе глины.
Заделка глиной кирпичной кладки
Совет: начинайте штукатурить кирпичную кладку только после полного ее застывания, тогда усадка не повлияет на результат. Обычно хватает 30 дней.
Знайте, что когда вы приготавливаете раствор для штукатурки печи – пропорции между компонентами глинопесчаной смеси зависят от жирности основного параметра, глины. Например, если она жирная – необходимо к 1 части глины добавить 4 части песка.
Совет: увеличить прочность штукатурного раствора поможет стекловолокно или асбест, которые необходимо добавить в готовую смесь.
Если же вам нужно приготовить раствор для штукатурки печной трубы, знайте, в нем обязательно должна быть гашеная известь. Иначе он отвалится от кирпичной кладки из-за конденсата.
Технология оштукатуривания печи
Ниже предлагается готовая инструкция к действию:
Подготовка
- Поверхность кирпичной кладки следует подготовить, очистив ее от грязи и остатков раствора (шпателем или щеткой по металлу), а также пыли (мягкой щеткой).
Совет: расчистите швы между кирпичами на глубину 5-10 мм, чтобы штукатурка лучше цеплялась к основанию.
- Забейте в стыки гвозди (l=40—50 мм) с шагом до 150 мм. Они должны выступать наружу примерно на 10 мм.
- Не поленитесь, обработайте поверхность кладки грунтовкой.
- Создать шероховатую поверхность и придать прочность раствору вам поможет также сетка из стекловолокна.
 Прикрепите ее к кладке жидкой смесью.
Прикрепите ее к кладке жидкой смесью.
Совет: проводите оштукатуривание только горячих стенок.
Штукатурная металлическая сетка для раствора
Процесс
- Смочите кирпичную кладку водой. Раствор штукатурки наносите послойно.
- Первый слой сделайте жидким, консистенции сметаны.
- Наносите второй после отвердения первого, его толщина до 10 мм. Дождитесь, пока он схватится.
- Выровняйте поверхность. Для этого подождите, пока схватится раствор, и затрите все неровности на ней, предварительно смочив водой.
Совет: появившиеся после высыхания трещины расшейте, смочите водой, заполните раствором и, после его высыхания, затрите.
Требования к раствору
Печная штукатурка должна обладать особыми характеристиками, которые существенно отличаются от традиционных цементно-песчаных растворов, использующихся для отделки домов. Связано это с условиями ее работы – печная кладка расширяется при нагревании, поэтому крайне важно, чтобы готовая смесь была эластичной.
Приготовление раствора
Второй параметр – хорошая теплопроводность материала, чтобы печь быстро могла прогреть помещение.
Для этой цели в раствор добавляют разные компоненты:
- глину;
- асбест;
- шамот;
- соль;
- стекловолокно.
Может применяться простая глина и сложные растворы на ее основе. Их можно приобрести в строительном магазине или сделать своими руками.
Таблица подготовки штукатурных смесей
Смеси для штукатурки печей
Каким раствором штукатурить печь – вопрос серьезный, так как от этого многое зависит. Компоненты в растворе могут иметь разное соотношение друг с другом в зависимости от жирности глины.
Ее жирность разбавляется песком, соответственно, чем выше данный параметр, тем больше песка понадобится. При смешивании вначале соединяются между собой сухие составляющие, куда затем добавляют глину или известь.
Совет: добавьте 200 г соли на ведро глинопесчаного раствора, чтобы увеличить его прочность.
Ниже предлагаются рецепты, как приготовить раствор для штукатурки печи самостоятельно:
- Первый состав раствора для штукатурки печей, который часто применяется для оштукатуривания поверхностей печей: 1:1:1/10:2 (глина, известь, асбест и песок). Компоненты смеси необходимо тщательно перемешать между собой, доводить ее следует до нужной кондиции водой, которую необходимо постепенно добавлять в емкость.
- Второй способ: 2:1:1 (песок, глина цемент М400 или М500). Вначале размешайте глину с водой, чтобы получилось густое тесто. Затем добавьте в раствор асбест, цемент и воду, тщательно перемешайте. Густота смеси должна напоминать крутую сметану. Недостаток – выработать раствор необходимо за 60 минут.
Консистенция готового раствора
Перед тем, как сделать раствор для штукатурки печи, вы должны понимать, что в любом составе есть – вода и вяжущий заполнитель, который может быть один или в смеси с другими компонентами, в частности, известь с цементом. При использовании высокопрочного гипсового раствора помните, что схватывается он в течение 6 минут, а спустя 30 минут он непригоден к использованию.
При использовании высокопрочного гипсового раствора помните, что схватывается он в течение 6 минут, а спустя 30 минут он непригоден к использованию.
Вывод
Готовая смесь для штукатурки печей должна обладать особыми характеристиками, в частности, быть эластичной. Подготавливая раствор из рецептов, указанных выше, или из магазинных смесей необходимо это учитывать.
Приготовленный правильно раствор ровно и легко наносится на поверхность, а также без проблем заглаживается. Следите за вязкостью, которую регулируйте водой, не превышайте норму песка, иначе пластичность раствора пострадает. В представленном видео в этой статье вы найдете дополнительную информацию по данной теме.
Понравилась статья? Подписывайтесь на наш канал Яндекс.Дзен
Добавить в избранное
Версия для печати
Как сделать цветной раствор для кладки кирпича
Цветной раствор для кладки кирпича.
Декоративная кладка кирпича создаёт неповторимый дизайн экстерьера. Проблема иногда заключается в том, что швы не подходят по цветовой гамме. Этот вопрос решит цветной раствор для кирпича. Оттенок кирпича различается из-за партий.
Цветной и белый раствор для кладки кирпича.
Действительно ли нужен цветной раствор?
В строительстве использовался только стандартный серый цвет раствора для кладки. Это нарушает картину и портит внешний вид облицовочного кирпича при кладке. Неприятный эффект раствора: появление высолов на кирпиче воздействием влаги. После полного высыхания оттенок меняет сам шов кладки, что смотрится не так. Некоторые виды облицовочного кирпича забирают в себя влагу с цементом, что ярким оттенкам даёт сероватый цвет. Серая площадь шва занимает до 15% площади кладки. Это показатель, который вносит коррективы в цветовую палитру. Наряду со швом, испортить внешний вид может пыль, которая постоянно оседает на поверхности.
Проблему потускнения облицовочного кирпича решают несколькими способами. Опытные мастера применяют такие хитрости:
Опытные мастера применяют такие хитрости:
применение затирок;
покраска;
цветной раствор.
Затирка швов кафельной или другой плитки привычна. При этом подбирается оттенок, который лучше подходит к плитке. Некоторые мастера поступают таким же образом и для кладки из облицовочного кирпича. Затирочный состав для привлекательного вида шва. По времени процедура занимает некоторое время. Вариант не такой щепетильный, но расход материала также будет. Состав нанести на плоскость стены.
При этом швы меняют цвет, оттенок кирпича. Швы выделяют кирпич и материал приобретает дополнительный водоотталкивающий эффект. Благодаря этому снижается вероятность появления высолов. Последний метод приготовление раствора для кладки подходящего цвета. Нет необходимости в периодическом обновлении шва. Цвет сохраняется на протяжении времени.
Базовые пять пигментов для получения оттенка раствора. Это не означает, что этим стоит ограничиваться. При правильном соотношении дают до 30 оттенков, которые подойдут под кладку.
Правильный цветовой оттенок под конкретный вид облицовочного кирпича улучшает внешний вид, дает создать облик в зависимости времени суток. Длина лучей солнца играет, поэтому здание будет переливами и оттенять конкретный цвет, что смотрится. Способы выделить шов кирпичной кладки:
подчеркивание;
контраст;
слияние.
Первый способ подчеркнуть оттенок кирпича архитектором. Оттенок шва темнее и тускнее кирпичного, что даст блокам играть оттенками. Контрастный пигмент создаёт сочетание, построенное на противопоставлении. В этом случае важно использовать цвета, которые по палитре, но с оттенками. Последний вид подбора пигмента дает создать одноцветную плоскость. При этом шов не выделяется на фоне кирпича.
Раствор для контраста.
В раствор добавляют белый краситель. Это с контрастными свойствами. С облицовочным кирпичом выделяется. При этом кладка становится визуально легче. Это не касается светло-желтого оттенка кирпича. Некоторые заказчики не соглашаются на использование белого раствора потому что дорогая конечная стоимость. Для приготовления подобного рода состава понадобится:
Для приготовления подобного рода состава понадобится:
гашеная известь;
оксид цинка;
оксид титана.
Вещество для приготовления белого раствора для кладки оксид титана. Это связано со свойствами. Способен сохранять цвет на протяжении лет. При этом не темнеет под воздействием осадков. Красителем использовали вещества, которые имели в составе свинец. У металла вредная эмиссия, которая отрицательно сказывается на здоровье человека. Поэтому этой затеи отказались.
Хитрость сэкономить на приготовлении белого раствора.
Кладка кирпича не на объем белого раствора, который требуется, а на часть. Для этих целей делается приготовление цементного состава, который укладывается на кирпич таким образом, чтобы остался зазор, который выходит к лицевой стороне стены. Часть белого состава, который укладывается на пространство. Для изготовления второго понадобится цемент марки М-500 и цветной пигмент, которые смешиваются в таких пропорциях, чтобы получился оттенок. Плюсом использования контрастного белого раствора, что не появляются высолы дождевой воды. Кроме того, такой раствор для кладки противостоит проникновению влаги внутрь, т. к. плотна структура.
Кроме того, такой раствор для кладки противостоит проникновению влаги внутрь, т. к. плотна структура.
Цветные растворы.
Кроме контраста эффект слияния во время кладки кирпича.
В этом случае пигмент совпадает с цветом кирпича. При этом предоставляется визуально скрыть структуру стены. Сам шов при этом обрабатывается. Шов утопает заподлицо с блоками. Некоторые мастера добиваются того, чтобы текстура шва повторяла поверхность кирпича. Шов утопает на минимальную глубину, тогда эффект монолитности здания.
Во время кладки выбрать правильно расположение шва по отношению к краю кирпича, а также толщину. Если не соблюсти этих нюансов, тогда легко площадь влагопоглощения увеличится, что приведет к частичному растрескиванию кирпичей при эксплуатации. Подсказать такие нюансы может человек с опытом в строительстве. Во время подбора пигмента для цветного шва, требуется точный расчет количества. Это важно. Раствор высыхает и теряет часть окраса и осветляется, что нарушает гармонию. Пигмент может частично вымываться дождевой водой или тускнеть под воздействием ультрафиолета.
Пигмент может частично вымываться дождевой водой или тускнеть под воздействием ультрафиолета.
Доступные пигменты.
Чёрный. Серый. Темно-серый. Коричневый. Красно-коричневый. Каштан. Бежевый. Светлая охра. Белый.
Для цвета раствора порошки солей металлов. Для этих целей применяется:
железо;
хром;
кобальт;
медь.
Популярность из-за физических свойств. Соли этих металлов переносят перепады температур, воздействие осадков. Пигмент добавочное вещество, поэтому правильно подобрать компоненты для основы. Только в этом случае пигмент наберет цвет. Для ярких красок чаще используется белый цемент. Оттенок темнее, тогда подойдет и портландцемент. Для получения черного цвета использовать марки цемента с прочностью.
Вместо солей железа, для получения черного цвета раньше применялась сажа. Со временем стало ясно, что аморфный углерод отрицательно влияет на прочность раствора,- снижает. Связано это с тем, что проникновение влаги происходит в недостаточной степени. Сажу заменили комбинацией нескольких солей.
Сажу заменили комбинацией нескольких солей.
Способ приготовления.
Первая проблема, с которой придется столкнуться при приготовлении цветного раствора для кладки заключается в дозировках пигмента в белую или серую основу. Состав тщательно перемешивать при приготовлении, т. к. полный оттенок набирает только после полного растворения красителя. Риски небольшие. Предварительные замесы с количеством красителя, воды. Краситель не стоит высыпать в раствор в порошкообразном состоянии. Лучше предварительно растворить в теплой воде. При этом удалить частички.
в бетономешалку, в емкость миксера загрузить по порядку:
1. пигмент;
2. половину количества цемента;
3. третью часть песка.
Раствор пигмента частично вливается сразу и потом добавляется по ходу. Далее добавляется остаток цемента и песка. Пигмент в растворе присутствует не выше десятой части для марки М-100 и двенадцатой части для марки М-75. Готовые растворы с пигментами для кладки. Лучше брать в том случае, когда требуется приготовление смеси со сложным оттенком. Готовый раствор обойдется дешевле, т. к. для ручного приготовления перерасход компонентов в силу пробных замесов.
Готовый раствор обойдется дешевле, т. к. для ручного приготовления перерасход компонентов в силу пробных замесов.
Мастера, с опытом в использовании цветных растворов для кладки, разрабатывают собственные решения для внешнего вида строений. Использование флюоресцирующего компонента. Не добавляется отдельно, а для этого применяется порошок из стекла. Результат — свечение сетки шва после захода солнца. Эффект проявляет себя на протяжении нескольких часов.
Шов, который будет реагировать на изменение температуры окружающей среды. Для этого швы затираются раствором с добавкой состава. Температура понижается,- состав приобретает синий оттенок, а когда повышается, тогда оттенок приобретает мягкие тона, которые ближе к красному. Бесконечное количество компонентов для придания оттенка раствору для кладки. Во время экспериментов подбирать такие компоненты, которые не будут влиять на качество и прочность раствора.
Нюансы приготовления цветного раствора для кладки. Важно с рассудительностью подходить к количеству и качеству пигмента. Порцию, нанести на кирпич и посмотреть, как это будет выглядеть после полного высыхания. Только таким образом останетесь довольны конечным результатом.
Порцию, нанести на кирпич и посмотреть, как это будет выглядеть после полного высыхания. Только таким образом останетесь довольны конечным результатом.
Как сделать раствор для штукатурки стен своими руками. Приготовление штукатурного раствора для стен
При строительстве любого здания особое внимание следует уделить штукатурке. Благодаря нанесению этого слоя стены получают хорошую защиту от влаги. При этом поверхность штукатурки за счет своей пористости отлично пропускает воздух, благодаря чему стены «дышат». Это препятствует появлению грибка и плесени на их поверхности. К тому же слой штукатурки отлично влияет на теплоизолирующие качества стены, благодаря чему заметно снижаются потери тепла. Обработанную штукатуркой стену можно отделывать любыми материалами: обоями, финишной шпаклевкой «под покраску» и др.
В настоящее время предложение готовых смесей для штукатурки поверхностей просто огромно. Стоимость одного мешка штукатурки сейчас уже не столь высока, как несколько лет назад. Однако, учитывая, сколько мешков не совсем дешевого материала может уйти на одну комнату, задача уже не кажется такой простой. Для удешевления ремонтных работ можно приготовить штукатурку самостоятельно. Процесс этот не слишком сложный, но может существенно сэкономить средства, за счет невысокой стоимости ингредиентов. О том, как приготовить раствор для штукатурки стен своими руками – далее в статье.
Однако, учитывая, сколько мешков не совсем дешевого материала может уйти на одну комнату, задача уже не кажется такой простой. Для удешевления ремонтных работ можно приготовить штукатурку самостоятельно. Процесс этот не слишком сложный, но может существенно сэкономить средства, за счет невысокой стоимости ингредиентов. О том, как приготовить раствор для штукатурки стен своими руками – далее в статье.
Из чего состоит штукатурка
Для того чтобы качественно приготовить штукатурку для отделки стен, необходимо знать из каких основных частей она состоит, и какие вещества для этого применяются.
В основе смеси каждой смеси для штукатурки стен лежат два компонента:
- Вяжущее вещество. Этот компонент отвечает за затвердевание раствора при его высыхании.
- Наполнитель. Он не только увеличивает объем смеси, но и препятствует ее чрезмерному пересыханию. Без него штукатурка будет непрочной, быстро растрескается и разрушится.
Правильно подобранные компоненты штукатурки и их пропорции в зависимости от условий ее использования станут залогом успеха всего предприятия.
В качестве наполнителя для приготовления штукатурки чаще всего используют песок. Наиболее качественным для строительных работ считается речной песок. Карьерный песок довольно часто имеет примеси глины, что негативно сказывается на его свойствах, а в морском — большое содержание солей. При добавлении песка в раствор, его необходимо просеять, чтобы штукатурка не содержала больших кусков. В противном случае они будут тянуться за шпателем, оставляя борозды. Размер ячейки сетки для просеивания песка должен быть 3-4 мм.
Если с наполнителем все более или менее понятно, то в качестве вяжущего вещества может применяться несколько различных компонентов. Их использование зависит от того, для каких целей будет применяться раствор. В качестве вяжущих веществ используют:
- Гипс. Этот материал обычно применяется как добавка в известковый раствор штукатурки, которая улучшает его свойства. Благодаря гипсу раствор начинает схватываться намного быстрее, а через 30-40 минут полностью затвердевает.
 При этом штукатурка с добавлением гипса практически не дает усадку. Гипс в некоторых случаях применяется в чистом виде.
При этом штукатурка с добавлением гипса практически не дает усадку. Гипс в некоторых случаях применяется в чистом виде. - Цемент. Этот материал является самым крепким среди вяжущих веществ для штукатурки. Твердость цемента обозначается цифрами. Чем выше число на упаковке, тем выше твердость. Для приготовления штукатурки в основном применяется цемент марки 400, так как большой твердости для этой работы не требуется. Цемент, в отличие от гипса, застывает несколько дольше. Полностью раствор на основе этого материала набирает прочность через 28 дней.
- Глина. В основном штукатурка на основе глины применяется для внутренних работ. Благодаря особым качествам глины, растворы на ее основе обладают отличной термоизоляцией. Зимой в домах, стены которых оштукатурены глиной, всегда тепло, а летом прохладно.
- Известь. Это наиболее часто используемый материал для приготовления штукатурных растворов. От степени готовности известь делится на:
- гашеную;
- негашеную.

Вторая для приготовления штукатурки, ровно, как и для других строительных работ, не применяется. Перед использованием известь необходимо погасить. Негашеная известь при приготовлении раствора, в который обязательно входит вода, вступает с последней в бурную реакцию, что может стать причиной разрушения штукатурки.
Негашеная известь различается по своему химическому составу, и, соответственно, имеют свою скорость гашения:
- Быстрогасящаяся известь имеет скорость реакции около 10 минут. Ее засыпают в емкость с водой и тщательно перемешивают. После появления пара добавляют еще воду и опять перемешивают.
- Среднегасящаяся известь гасится примерно 25 минут. Засыпается известь в количестве примерно 25% объема емкости, затем до половины заливается вода. Как только появится пар, необходимо долить еще воды.
- Медленногасящаяся. Такая известь не заливается, а лишь слегка смачивается водой. Скорость гашения такого материала превышает 30 минут.
Готовить (гасить) известь для известкового раствора штукатурки своими руками не слишком сложно. Для приготовления самого раствора используется не известь, а известковое молочко. После того, как материал залит водой, его куски постепенно начинают разрушаться, а температура извести начинает расти. Затем на поверхности раствора появится корка. После этого в него добавляют воду и тщательно перемешивают. В результате таких действий твердые частицы осядут на дно, оставив на поверхности только известковое молочко. Последнее процеживается через специальное сито и сливается в специальную яму. Через 24 часа в яму добавляют просеянный песок и землю. Общая толщина слоя добавок должна составлять 50 см.
Для приготовления самого раствора используется не известь, а известковое молочко. После того, как материал залит водой, его куски постепенно начинают разрушаться, а температура извести начинает расти. Затем на поверхности раствора появится корка. После этого в него добавляют воду и тщательно перемешивают. В результате таких действий твердые частицы осядут на дно, оставив на поверхности только известковое молочко. Последнее процеживается через специальное сито и сливается в специальную яму. Через 24 часа в яму добавляют просеянный песок и землю. Общая толщина слоя добавок должна составлять 50 см.
Весь раствор выдерживается в яме около двадцати суток, после чего достается из ямы непосредственно перед приготовлением известкового раствора. За это время известковое молочко значительно загустевает и получает консистенцию густой сметаны. При этом известь гасится окончательно.
Свойства некоторых растворов для штукатурных работ
Чтобы приготовить годный для той или иной работы штукатурный раствор, необходимо знать свойства каждого из них.
Растворы на основе гашеной извести:
- Известковый раствор для штукатурки стен своими руками готовится на основе известкового теста и песка. Пропорции материалов в растворе: 1 часть теста на 3 части песка. Для лучшего перемешивания в емкость для приготовления раствора штукатурки добавляется вода. После окончания перемешивания готовая для применения штукатурка должна иметь консистенцию густого теста. Применяется, как правило, для внутренних работ. Не обладает особой прочностью.
- Чтобы известковый раствор стал прочнее, в него добавляют цемент в пропорции до 10% от общего объема. Такая смесь имеет название цементно-известковый раствор. Отличительной особенностью данных штукатурок является большое время застывания, что позволяет работать с ними довольно долго.
- Раствор с добавлением гипса. В первый вариант штукатурки добавляют гипс по пропорции: 1 часть гипса на 5 частей известкового раствора (песок + известковое тесто). В отличие от штукатурки с добавлением цемента, сохнет гипсовый раствор очень быстро, что доставляет определенные неудобства начинающим мастерам.
 Однако, этот факт определяет его пластичность и прочность.
Однако, этот факт определяет его пластичность и прочность. - Глиняная смесь. Такая штукатурка готовится на основе известкового и глиняного теста в пропорции 1:1. Отличается особой прочностью. За счет экологичности и отличных теплосберегающих свойств глины прекрасно подходит для внутренних работ.
Растворы строительные штукатурные на основе глины. Полностью глиняная штукатурка отличается особой технологией приготовления. Глину обильно смачивают водой и накрывают плотной тканью. После того, как она разбухнет, в нее добавляют три части наполнителя. Чаще всего в качестве последнего используют опилки или солому. К достоинствам такого раствора можно отнести экологичность, низкую себестоимость и отличные теплоизоляционные качества. Однако, прочность такого раствора оставляет желать лучшего.
Для увеличения прочности глины в штукатурку на ее основе добавляют цемент (примерно 10% от общего объема раствора).
Также часто при внутренней отделке помещений используют гипсово-глиняный раствор. Готовится он таким же образом, как и известковый раствор с добавлением гипса.
Готовится он таким же образом, как и известковый раствор с добавлением гипса.
Цементные растворы:
- Цементно-песчаный раствор для штукатурки стен своими руками готовится в пропорции 1:3 или 1:4. Выбирается она в зависимости от условий нанесения и эксплуатации штукатурки. Чем жестче условия – тем больше цемента.
- Цементно-известковый раствор готовится на основе 2 частей цементов марки М-400 или М-500 с добавлением 1 части известкового теста и 2 частей просеянного песка. Цемент придает любому раствору прочности и гидроизоляционные качества. Именно поэтому его часто применяют для наружных работ.
Существует два способа приготовления цементно-известкового раствора. При первом песок смешивается с известковым тестом, после чего в раствор добавляется цемент и вода до достижения нужной консистенции. При втором – цемент перемешивается с песком, далее в полученную однородную массу добавляется известковое молочко до приобретения раствором необходимой консистенции.
Штукатурка стен цементным раствором своими руками – наиболее часто встречающийся вид внешней отделки зданий.
Как сделать раствор для штукатурки стен. Правила приготовления штукатурного раствора
- При приготовлении любого раствора необходимо использовать материалы без примесей в четко указанных пропорциях. Сам раствор должен быть однородным, иметь среднюю жирность, нормально фиксироваться на поверхности, и не растрескиваться при высыхании. Слишком жирные растворы (те, у которых большое содержание вяжущего компонента) при высыхании могут растрескиваться. При замешивании такой жирный раствор слишком прилипает к лопатке смесителя. В таких случаях в него необходимо добавить заполнитель.
- Если готовый раствор совсем не прилипает к смесителю, он называется «тощий». В таком случае обязательной является добавка вяжущего вещества.
Штукатурка наружных стен цементным раствором своими руками: фото
Штукатурка стен цементно-песчаным раствором своими руками: видео
Как сделать огнеупорный раствор для печи который не треснет
Чтобы облагородить кирпичную кладку печки обычная штукатурка не подходит, так как при нагреве она растрескается и осыпаться. Для этого нужен специальный огнеупорный раствор. Его можно сделать своими руками из недорогих доступных в каждом строительном магазине материалов.
Что потребуется:
- гашеная известь;
- просеянная через сито зола;
- жидкое силикатное стекло;
- вода;
- пищевая соль.
Процесс приготовления щелочной штукатурки
На одну порцию штукатурки нужно приготовить 6 л просеянной через сито золы. Она смешивается в большой емкости с 1 кг обычной пищевой соли.
Далее необходимо затворить в воде 1 кг гашеной извести до получения консистенции известкового молока.
Молочко понемногу вливается в емкость с золой и солью. Его потребуется столько, чтобы получить раствор пригодный для штукатурки. От молочка должен остаться густой осадок, который в щелочную штукатурку лучше не вливать, так как он не перемешается как нужно, чем снизит прочность.
Его потребуется столько, чтобы получить раствор пригодный для штукатурки. От молочка должен остаться густой осадок, который в щелочную штукатурку лучше не вливать, так как он не перемешается как нужно, чем снизит прочность.
Полученный состав уже может использоваться для штукатурки печки, но если необходимо делать выравнивание слоями в пару сантиметров, то требуется также влить жидкое силикатное стекло. Оно добавляется в таком количестве, чтобы раствор приобрел нужную пластичность и перестал растекаться на вертикальных поверхностях.
Смачиваем поверхности которые необходимо обработать.
Штукатурим.
После оштукатуривания следует заложить печку дровами и протопить. По мере нагрева влага из штукатурки начнет испаряться. Как следствие раствор будет усаживать и между ним и металлическими поверхностями появятся зазоры. Сразу же по мере их проявления штукатурка приглаживается.
Если не полениться и все же протопить печь, то штукатурку можно сделать за один раз добившись полной герметичности.![]() В первое время при схватывании раствор будет становиться еще более пластичным и удобным в работе, практически как гипсовая штукатурка. Как только состав станет плотным и перестанет усаживаться, дрова можно уже не подбрасывать, и дать штукатурке несколько дней для полного высыхания и затвердевания естественным способом.
В первое время при схватывании раствор будет становиться еще более пластичным и удобным в работе, практически как гипсовая штукатурка. Как только состав станет плотным и перестанет усаживаться, дрова можно уже не подбрасывать, и дать штукатурке несколько дней для полного высыхания и затвердевания естественным способом.
Щелочную штукатурку по этому рецепту при необходимости можно использовать прямо в отопительный сезон для ремонта трещин в кладке печки. Если нужно, она высохнет и крепко схватиться даже на постоянно горячей поверхности. Единственное, что при работе в таких условиях в непроветриваемом помещении будет присутствовать запах извести и мокрой золы.
Смотрите видео
как приготовить смесь, глиняный состав, пропорции для оштукатуривания, соотношение глины и песка, как сделать
Счастливых владельцев частных домов интересуют множество вопросов, так или иначе связанных со строительной тематикой. Если для жителей квартиры ремонт превращается в долговременный кошмар, способный значительно ухудшить качество жизни и потребовать значительных финансовых вложений. Для хозяина загородного дома ремонтные работы не прекращаются никогда, поэтому абсолютное большинство приобретают необходимые навыки, так сказать, в процессе.
Если для жителей квартиры ремонт превращается в долговременный кошмар, способный значительно ухудшить качество жизни и потребовать значительных финансовых вложений. Для хозяина загородного дома ремонтные работы не прекращаются никогда, поэтому абсолютное большинство приобретают необходимые навыки, так сказать, в процессе.
Одним из важных вопросов, которые мы и рассмотрим в нашей статье, является выбор качественной смеси для оштукатуривания печи. Даже если у вас в доме автономное газовое или электрическое отопление, печные работы могут возникнуть при проектировании бани, сауны или даже камина, которым так любят украшать дома владельцы. Если вы только начали строительство, то здесь описаны размеры огнеупорного кирпича для кладки печи, по ссылке описано, как сделать раствор для кладки печи. Также вы можете ознакомиться с информацией о том, какой кирпич лучше для печи.
Состав
Покрытие поверхности печи отделочным слоем носит не только эстетический характер. Благодаря ему в помещение не будет проникать дым из возможных щелей в кладке печи, а также использование такого оборудования будет более безопасным и удобным.
Благодаря ему в помещение не будет проникать дым из возможных щелей в кладке печи, а также использование такого оборудования будет более безопасным и удобным.
Оптимальный раствор для штукатурки печи должен соответствовать следующим требованиям:
- Не трескаться под воздействием температур.
- Образовывать ровную однородную поверхность.
- Являться безопасным для человека, не выделять наружу химических веществ.
- Желателен максимально возможный срок беспроблемной эксплуатации.
Различают домашние (самодельные) и готовые смеси. Использование обоих типов имеет свои преимущества и недостатки. Для работы по оштукатуриванию поверхностей печи понадобится определенный строительный инструмент, а также минимальные навыки по выполнению подобных действий.
На видео – глиняный раствор для штукатурки печи:
Смесь для пользования своими руками
Большинство самодельных видов смеси готовятся на основе глины, песка и цемента. Использование химических пластификаторов и добавок должно быть исключительно подходящих марок, но обычно можно обойтись и вышеприведенными ингредиентами.
На основе бесценного строительного опыта множества домашних умельцев собрана подборка лучших рецептов приготовления таких смесей. Главное здесь — выдержать пропорции для раствора. Готовность смеси необходимо определять, что говорится «на глаз»: сметанообразная вязкая паста не должна быть слишком жидкой. Именно такая консистенция будет легче наноситься и обеспечит все необходимые характеристики готового покрытия. Вымешивать раствор лучше всего специальной насадкой «миксер» для дрели.
На видео рассказывается, как сделать раствор для штукатурки печи своими руками:
Рецепт № 1: глинянно – песчаная смесь
Традиционно используется глина в качестве главной составляющей. У каждого мастера могут немного видоизменяться соотношение и состав смеси. Классический рецепт, который можно взять за основу, приведен далее.
Необходимые ингредиенты:
- 1 часть глины.
- 2 части речного песка.
- 0,1 части асбестового или стекловолокна.
- Чистая вода.
В зависимости от жирности глины может потребоваться увеличить долю песка в составе. Вместо асбестового волокна, которое придает смеси пластичность и прочность, ранее использовали солому и измельченные части пеньки. Это, конечно же, более экологичный вариант. Весьма необычным способом дополнительного армирования будет использование небольших кусков мешковины, предварительно вымоченных в растворе.
Это, конечно же, более экологичный вариант. Весьма необычным способом дополнительного армирования будет использование небольших кусков мешковины, предварительно вымоченных в растворе.
Как сделать потолок из МДФ своими руками?
Здесь можно посмотреть фото панелей для наружной отделки дома.
Отзывы о фиброцементные панелейдля наружной отделки дома: https://resforbuild.ru/paneli/dlya-sten/fibrocementnye-dlya-naruzhnoj-otdelki-doma.html.
Рецепт № 2: цементно – глинопесчаная смесь
Обеспечить дополнительную твердость покрытия должен цемент в составе, поэтому часто используется и другой рецепт приготовления таких смесей. Перед формированием смеси очень важно убедиться в качестве цемента, ведь этот материал очень капризен при хранении, и даже малейшее попадание влаги способно безвозвратно погубить нужные характеристики.
Необходимые ингредиенты:
- 1 часть портландцемента.
- 1 часть глины.

- 2 части речного песка.
- 0,1 части асбестового или стекловолокна.
- Чистая вода.
Глину для печного раствора необходимо тщательно просеять и замочить в воде примерно на ночь, чтобы она хорошо разбухла.
На видео – раствор для штукатурки домашней печи:
Рецепт № 3: известково – глинопесчаная смесь
В такие растворы часто добавляют и известь для придания дополнительной пластичности и визуальной привлекательности нанесенного покрытия. Этот материал выступает в качестве натурального пластификатора, но немного замедляет общее время сушки слоя.
Необходимые ингредиенты:
- 1 часть гашеной извести.
- 2 части речного песка.
- 0,1 части асбестового или стекловолокна.
- Чистая вода.
Песок перед вымешиванием раствора необходимо хорошо просеять от мусора и ненужных включений. Оптимально использовать речной песок, который по своим характеристикам прекрасно подходит для отделки печи.
Рецепт № 4: известково – гипсовая смесь
Характерной особенностью такой разновидности печной отделки будет исключительно быстрое застывание раствора. Это объясняется наличием гипса в составе, который полностью твердеет уже через полчаса после разведения с водой. Целесообразней будет использовать небольшое количество смеси за раз, чтобы избежать ненужных затрат и трудопотерь.
Необходимые ингредиенты:
- 2 части гашеной извести.
- 1 часть строительного гипса.
- 1 часть речного песка.
- 0,2 части асбестового или стекловолокна.

- Чистая вода.
Приготовленный по этому рецепту состав обладает исключительной твердостью и как уже было сказано ранее, очень быстро сохнет, что также в определенных условиях играет только положительную роль для эксплуатации печного оборудования.
Важный нюанс: наносить слой штукатурки по любому из предложенных рецептов необходимо на чуть теплую печь, чтобы впоследствии поверхность не полопалась.
Стоит ли использовать готовые продукты
Традиционные рецепты, несмотря на хорошую проверку временем часто не дают желаемый результат. Причин может быть несколько, вплоть до несоблюдения температурного режима и низкого качества сырья. Не следует списывать со счетов и необходимую квалификацию, которую в наше время редко можно встретить. Раньше хороших печников знали в радиусе многих километров, но сейчас эта профессия практически исчезла.
Именно для трудных случаев, особенно когда попросту нет времени заниматься необходимым подбором материалов и изучению опытным путем всех предложенных рецептов, существует вариант с использованием специальных готовых смесей. Приобрести такие можно в строительном магазине, особенно поможет в этом консультация продавца. Готовые смеси для оштукатуривания печи — товар специфический, поэтому время поисков может затянуться.
Приобрести такие можно в строительном магазине, особенно поможет в этом консультация продавца. Готовые смеси для оштукатуривания печи — товар специфический, поэтому время поисков может затянуться.
На видео – пропорции для раствора для штукатурки печи:
Также при выполнении работ рекомендована предварительная обработка поверхности термостойкой грунтовкой, а для армирования можно использовать мелкоячеистую стальную сетку. Алгоритм действий и необходимые пропорции сухой смеси и воды указаны на упаковке и могут отличаться у разных производителей. А о том, какие есть огнеупорные материалы для печей читайте в нашей статье.
А о том, какие есть огнеупорные материалы для печей читайте в нашей статье.
Также следует учесть, что стоимость готовых смесей априори выше самодельных растворов. Если этот момент не принципиален, вполне можно воспользоваться именно таким вариантом.
Оштукатуривание печи — дело весьма важное и ответственное. От качества верхнего слоя будет зависеть эстетический вид помещения, а также удобство использования печного оборудования. Сквозь небольшие щели и трещинки между кирпичами печи может просачиваться дым и вредные вещества, поэтому облицовка так важна для противопожарной безопасности и здоровья домочадцев.
Для штукатурки печи используются самодельные растворы, несколько рецептов которых приведены в нашей статье. Существуют также покупные смеси, в которых уже просчитаны необходимые пропорции, осталось только добавить воды и вымешать. Использование готовых смесей увеличит стоимость работ, но превосходный результат будет просто гарантирован. Возможно, вам также будет полезна информация о видах декоративных штукатурок для внутренней отделки. Отзывы о теплой штукатурке вы найдете тут. Также читайте о том, как сделать фактурную штукатурку из шпаклевки.
Отзывы о теплой штукатурке вы найдете тут. Также читайте о том, как сделать фактурную штукатурку из шпаклевки.
состав и пропорции, как приготовить смесь своими руками, соотношение глины и песка для оштукатуривания
Печь издавна являлась надежным, а подчас и единственным, источник тепла и энергии. В современном мире она так и не утратила свое значение: многие люди стремятся поселиться за пределами городов в уютном и теплом доме. Если воспользоваться услугами профессионального печника невозможно, не печальтесь!
В этой статье мы подробно расскажем, как и чем лучше всего приводить в должный образ вашу старую добрую «каменку», после чего вы сами сможете попробовать себя в роли печника и отреставрировать свою печь.
Подготовка печи
Прежде чем приступать к приготовлению раствора для декоративной штукатурки, следует подготовить наше рабочее место:
- печь следует очистить от грязи и мусора, качественно удалить остатки прежнего раствора;
Подготовка печи
- следует очистить и немного углубить щели между кирпичами (не более, чем на 0,3-0,7 см): это улучшит сцепление нашего раствора с кирпичной кладкой;
- перед началом самой работы также рекомендуется слегка протопить печь, чтобы нанести раствор на теплую поверхность и выровнять: в результате этого внешний слой штукатурки не полопается.

Более подробно о штукатурке печи смотрите на видео:
Инструменты, без которых не обойтись:
- емкость для приготовления раствора;
- кельмы и шпатели;
- кисти.
Приготовление раствора
В мире существует множество рецептов растворов для штукатурки. Вам необходимо знать приготовление штукатурки своими руками. Ниже приведен состав наиболее качественных и популярных из них (пропорции в частях):
- Песок – 2, цемент – 1, глина – 1, асбест – 0,1;
- Глина – 1, песок – 2, асбест – 0,1;
- Гипс – 1, известь – 2, песок – 1, асбест – 0,2 (в данном случае асбест можно заменить стекловолокном в той же пропорции).

Теперь подробнее по каждой составляющей:
Глину – важную часть любой штукатурки – некоторые печники за день до отделочных работ замачивают в воде, чтобы она смогла разбухнуть и напитаться жидкостью.
Приготовление раствора
Песок лучше всего применять речной. Перед применением следует очистить его от мусора (ракушек, камней и т.п.), если он имеется, и просушить, чтобы точно определить пропорции будущего раствора.
Известь является отличной составляющей подобной смеси, т.к. обеспечивает ее надежную хватку с поверхностью. Тем не менее не стоит забывать, что раствор, содержащий в себе известь, будет застывать дольше обычного.
То же касается и цемента. Если вы собираетесь использовать его, будьте готовы, что схватывание завершится не менее чем через 12 часов, а окончательная прочность будет достигнута лишь через 20-30 дней. Качественный раствор штукатурки должен наноситься на стенки печи легко.
Состав раствора
Первый вариант раствора является наиболее популярным.
В его состав входят глина, асбест, песок и известь в следующих пропорциях: 1:0,1:2:1. Все это требуется тщательно перемешать, а после довести до нужного состояния с помощью воды, которую нам необходимо постепенно добавлять в раствор, перемешивая его.
В итоге мы получим нечто, похожее на сметану: получившийся раствор не должен быть слишком жидким или густым.
Состав раствора
При другом варианте раствор для штукатурки включает в себя глину, песок, цемент М400 или М500 и асбест в таких пропорциях: 1:2:1:0,1.
Для начала вам нужно смешать глину с водой, дабы получилось густое тесто. После этого добавьте в получившуюся смесь асбест, цемент и немного воды, чтобы раствор по густоте напоминал сметану.
Стоит отметить, что недостатком данного рецепта является то, что выработать раствор следует за 60 минут: подобные вещества быстро схватываются и вскоре становятся непригодными для использования.
Стеновые панели, изготовленные из современных материалов, появились сравнительно недавно и быстро завоевали свою популярность.
Здесь все о листовых стеновых панелях для внутренней отделки.
Стяжка – это специальный слой из смеси песка – цемента, с помощью которого делают хорошее основание для пола. Перейдя по ссылке ознакомитесь с сухой стяжкой пола.
Современный рынок строительных материалов предлагает панели на любой вкус и под любой запрос, помимо стоимости, влагостойкие листы значительно проще смонтировать. Листовые влагостойкие стеновые панели — лучшие из всех панелей.
Любой раствор для штукатурки должен быть однородным и эластичным. Чтобы достичь такого эффекта, требуется качественно перемешивать смесь во время ее приготовления до тех пор, пока она не станет однородной.
Для экономии ваших средств, нужно знать расход компонентов на 1 м2. Как рассчитать расход, можно посмотреть на примере штукатурки короед.
Нанесение раствора на ранее подготовленную поверхность
Штукатурку печи можно отнести к одному из видов штукатурки внутренней отделки.
Еще раз напомним, что работать можно лишь с ранее натопленной печью. Это очень важно! Но не будем забывать и о некоторых других тонкостях печного дела. Так, рекомендуется перед нанесением раствора установить на печь металлическую крупноячеистую (ячейки не должны быть крупнее 2х2 см) сеть.
Это очень важно! Но не будем забывать и о некоторых других тонкостях печного дела. Так, рекомендуется перед нанесением раствора установить на печь металлическую крупноячеистую (ячейки не должны быть крупнее 2х2 см) сеть.
Это в разы укрепит слой штукатурки, наделив его дополнительной прочностью.
Нанесение раствора
Не забывайте, штукатурка наносится в несколько слоев (толщина каждого из них не должна превышать 5 мм, а общая – 1 см). После нанесения каждого такого слоя, следует дать ему немного времени, чтобы схватиться с поверхностью. Раствор должен обязательно наноситься ровно, сверху вниз.
Не забудьте затереть штукатурку специальной теркой, чтобы она стала ровной и аккуратной. Делать это рекомендуется круговыми движениями, без сильного давления на поверхность.
Далее следует дать штукатурке просохнуть и настояться. Обычно на это хватает 12 часов. Если после истечения данного срока вы обнаружили на печке трещины, следует аккуратно смочить водой и затереть раствором, который мы использовали ранее.
Стоит ли покупать готовую смесь?
Несомненно, заводской раствор, купленный на строительном рынке, будет более надежным при оштукатуривании печи. Они производятся из специальных компонентов для внутренней отделки, которые придают смеси множество полезных свойств: она будет способна выдержать более высокие перепады температур (до +200…+250⁰C).
Оштукатуривание печи таким раствором практически ничем не отличается от процесса нанесения глиняного раствора, приготовленного своими руками. К тому же, на всех заводских смесях имеется специальная инструкция, в которой обозначаются тонкости работы с выбранным вами составом.
Готовая смесь
Минусом такого подхода является цена: себестоимость раствора, приготовленного своими руками, будет несколько ниже себестоимости купленного на рынке товара.
Заключение
Вне зависимости от того, решили вы купить готовую смесь или сделать собственную, следует помнить о правилах обращения с подобными веществами, а также о технике безопасности.
Кроме того, данный процесс является медленным и достаточно тонким: важно соблюдать пропорции, и правильно наносить состав на поверхность печи.
От того, как вы это сделаете, будет зависеть качество всей работы: вряд ли кто-то захочет повторно совершать такие операции. Желаем удачи!
Как приготовить раствор для линз в домашних условиях?
Часто случается, что раствор для линз заканчивается в самый неподходящий момент, или Вы забываете взять его с собой в гости, на дачу и пр. Неправильное хранение или длительное ношение оптических изделий может негативно сказаться на здоровье глаз. В данной статье мы рассмотрим, чем можно заменить жидкость для линз в домашних условиях.
Главной задачей раствора является обеззараживание линз от бактерий и микробов, поэтому обычная вода не подойдет для данной цели. Также не следует забывать, что для проведения процедуры Вам понадобится емкость, позволяющая заменить специальный контейнер. Как правило, в данном случае используется стеклянная посуда: стакан или бокал, которые предварительно рекомендуется прокипятить.
Как правило, в данном случае используется стеклянная посуда: стакан или бокал, которые предварительно рекомендуется прокипятить.
Альтернатива раствору для контактных линз
Если у вас нет возможности воспользоваться профессиональными средствами для очистки оптических изделий, рекомендуется выбрать:
- Физраствор, или аптечный раствор натрия хлорида 0.9%. Данное средство использовали для хранения линз до того, как появились современные аналоги. Однако тогда они имели более жесткую структуру.
- Раствор пищевой соли.
- Капли для глаз. Достаточно безопасным и эффективным средством для хранения линз считаются глазные капли с отметкой «чистая слеза». Они увлажняют и дезинфицируют оптические изделия.
Как приготовить жидкость для обеззараживания линз своими руками?
Если поблизости нет аптеки, можно приготовить жидкость для обеззараживания и хранения линз с помощью подручных средств. Для этого Вам понадобится:
- 100 мл дистиллированной воды;
- емкость для хранения;
- соль в количестве 0,9 г.

Помните, что данное средство следует изготавливать только в стерилизованной таре. Ни в коем случае нельзя использовать воду из крана, а также превышать допустимое количество соли.
После приготовления вещества обязательно остудите его, налейте в подготовленную тару, а затем поместите туда средства коррекции и плотно закройте. Помните, что класть оптические изделия в данную жидкость можно только на ограниченное количество времени — нельзя оставлять их на целый день или ночь. В процессе последующей эксплуатации обратите внимание на самочувствие — при появлении дискомфорта, сухости или покраснения в глазах необходимо сразу снять линзы.
Изготавливать вещество в домашних условиях рекомендуется только в крайних случаях. По мере возможности рекомендуется использовать специальные профессиональные средства со сбалансированным составом. Это исключит риск появления раздражений и подарит максимальный комфорт в процессе эксплуатации.
В интернет-магазине MagazinLinz. ru Вы сможете по выгодной цене купить высококачественные линзы, а также растворы для ухода за ними: Renu, Ликотин и пр. Желаем удачных приобретений!
ru Вы сможете по выгодной цене купить высококачественные линзы, а также растворы для ухода за ними: Renu, Ликотин и пр. Желаем удачных приобретений!
Команда MagazinLinz.ru
Подготовка растворов
Подготовка решений
Растворы обычно готовят в лаборатории из твердых материалов, жидкостей или других растворов. Приведенные ниже описания предполагают знание расчетов, необходимых для определения концентрации растворов, способность точно взвешивать твердые вещества и пипетировать жидкости.
Из твердого материала
| (1) | Определите концентрацию и количество раствора, необходимого для эксперимента. |
| (2) | Рассчитайте количество растворенного вещества, необходимое для приготовления желаемого раствора. |
| (3) | Взвесьте количество растворенного вещества, рассчитанное на шаге (2), и возьмите мерную колбу соответствующего объема. |
| (4) | Добавьте растворенное вещество в мерную колбу. |
| (5) | Наполните мерную колбу примерно на две трети, закройте пробкой и перемешайте. Для этого переверните колбу, встряхните и верните колбу в вертикальное положение.Сделайте это десять раз. Обязательно держите пробку в колбе. |
| (6) | Осторожно наполните колбу до отметки, выгравированной на горлышке колбы. При необходимости используйте промывочную бутылку или пипетку. |
| (7) | Тщательно перемешайте раствор, плотно закупорив колбу и перевернув ее от десяти до двенадцати раз. |
Из жидкости или другого раствора
| (1) | Определите концентрацию и количество раствора, необходимого для эксперимента. |
| (2) | Рассчитайте количество исходного раствора или жидкости, необходимое для приготовления желаемого раствора (исходный раствор — это раствор с известной концентрацией, большей, чем раствор, который вы готовите). |
| (3) | Используйте пипетку для измерения количества раствора или жидкости, рассчитанного на шаге (2). |
| (4) | Добавьте раствор или жидкость в мерную колбу соответствующего объема. |
| (5) | Наполните мерную колбу примерно на две трети и перемешайте. |
| (6) | Осторожно наполните колбу до отметки, выгравированной на горлышке колбы. При необходимости используйте промывочную бутылку или пипетку. |
| (7) | Тщательно перемешайте раствор, плотно закупорив колбу и перевернув ее от десяти до двенадцати раз. |
Как приготовить раствор из маточного раствора
Исходный или стандартный раствор — это раствор, в котором вы точно знаете его концентрацию. Вы можете сделать маточные растворы в химической лаборатории или купить у производителей химикатов. Когда у вас есть исходный раствор, вы можете приготовить растворы более низкой концентрации, разбавив концентрированный исходный раствор.
Вы можете сделать маточные растворы в химической лаборатории или купить у производителей химикатов. Когда у вас есть исходный раствор, вы можете приготовить растворы более низкой концентрации, разбавив концентрированный исходный раствор.
Разбавлять означает добавлять определенное количество растворителя (воды) к определенному количеству концентрированного маточного раствора. Если вы добавите определенное количество растворителя к определенному количеству концентрированного исходного раствора, вы заметите, что количество растворенного вещества, присутствующего в исходном растворе, такое же количество, что и в разбавленном растворе.Разница лишь в том, что разбавленный раствор теперь содержит больше воды, чем исходный раствор, из которого он был приготовлен. В реальной жизни то, что вы только что прочитали, похоже на то, как вы добавляете больше воды в кофе или чай, чтобы осветлить его вкус. Добавляя больше воды, вы увеличиваете только количество воды в растворе, но не количество присутствующих в нем молекул кофе или чая. Вот иллюстрация разбавленного раствора, приготовленного из маточного раствора:
Вот иллюстрация разбавленного раствора, приготовленного из маточного раствора:
Из приведенного выше рисунка видно, что в концентрированном растворе содержится 7 молекул растворенного вещества, а в разбавленном — 7 молекул.Но в разбавленном растворе растворителя больше, чем в концентрированном.
Поскольку оба раствора содержат одинаковое количество молекул растворенного вещества, отсюда следует, что:
- количество молей химических веществ, присутствующих в концентрированном растворе, равно количеству молей химических веществ, присутствующих в разбавленном растворе
Если мы переведем предыдущее утверждение в математическое выражение, мы получим:
моль концентрированного раствора = моль разбавленного раствора
Но так как мы знаем, что количество раствора кофе в молях равно объему раствора, умноженному на его концентрацию в Молярности, то мы можем написать, что:
Объем (V) концентрированного раствора, умноженный на молярность (M) концентрированного раствора, равен объему (V) разбавленного раствора, умноженному на молярность (M) разбавленного раствора. Если мы переведем это в математическое выражение, то получим:
Если мы переведем это в математическое выражение, то получим:
Расчет концентрации разбавленного раствора
Как вы могли заметить, формула, которую мы только что вывели, является общей формулой для разбавления концентрированного раствора до раствора с меньшей концентрацией. Обратите внимание, что если вы указываете концентрацию раствора как 2 M , заглавная буква M часто используется для представления единицы (моль/л), которая является единицей концентрации, указанной в молярности.
Чтобы использовать формулу разбавления, вы должны знать как минимум три из четырех переменных в ней. Теперь давайте воспользуемся им, чтобы ответить на следующий вопрос:
.
Предположим, что в одном из ваших экспериментов по общей химии вам нужно использовать 2 М серную кислоту (H 2 SO 4 ) для определенной реакции, но ваш лаборант дал вам 5 МЗ 2 СО 4 . Как бы вы это сделали?
Как бы вы это сделали?
Решение
Поскольку из вопроса вы знаете нужную вам концентрацию серной кислоты, то следует, что вы должны определиться с тем, какой объем вам нужен. Итак, допустим, вам нужно 10 мл 2 M H 2 SO 4 . Из этого следует, что вы должны рассчитать объем исходного раствора, который вам нужно пипетировать, чтобы приготовить целевую концентрацию. Для этого необходимо вспомнить формулу разбавления. Эта формула говорит, что:
Теперь, если вы прочитаете вопрос еще раз, вы заметите, что все единицы соответствуют тому, что нам нужно вычислить.По этой причине нет необходимости конвертировать между единицами измерения. Следовательно:
Том с =? (Нам нужно рассчитать, сколько запаса нам нужно)
Vol dil = 10 мл (Это объем 2 М концентрации, который вам нужен)
M con = 5 M (это молярность концентрированного раствора)
M dil = 2 M (это молярность разбавленного раствора)
Если подставить приведенную выше информацию в формулу разбавления, то получится
Поскольку нам нужен объем концентрированного маточного раствора (объем с ), мы должны разделить как левую, так и правую часть знака равенства в приведенном выше уравнении (1) на 5 M. Если мы это сделаем, то получим:
Если мы это сделаем, то получим:
Исходя из расчета, вам нужно пипетировать 4 мл 5 М раствора серной кислоты, чтобы приготовить 10 мл 2 М раствора серной кислоты. Чтобы приготовить 10 мл 2 М раствора, необходимо сначала перенести около 5 мл дистиллированной воды в мерную колбу на 10 мл. Затем медленно добавьте 4 мл маточного раствора (серной кислоты). Встряхните колбу, а затем долейте дистиллированной воды до отметки 10 мл.
Внимание!
Как вы могли заметить, мы добавляли серную кислоту в дистиллированную воду в мерной колбе, а не наоборот. Почему?
Мы сделали это, чтобы раствор не взорвался. Как вы, возможно, знаете, серная кислота намного плотнее воды, поэтому, когда вы добавляете ее в воду, ее молекулы могут перемещаться внутри и хорошо смешиваться с молекулами воды. Однако, поскольку плотность воды меньше, чем у серной кислоты, если вы добавите ее к серной кислоте, ее молекулы создадут барьер, в котором вода окажется сверху, а серная кислота снизу. Этот нежелательный барьер может вызвать взрывную реакцию двух химических веществ (экзотермическая реакция), вырабатывая достаточно энергии, чтобы разбить колбу.По-другому вы можете предотвратить эту реакцию, поместив мерную колбу в баню со льдом и добавляя кислоту в дистиллированную воду. Лед будет поглощать энергию, выделяемую раствором, в результате чего раствор охлаждается.
Этот нежелательный барьер может вызвать взрывную реакцию двух химических веществ (экзотермическая реакция), вырабатывая достаточно энергии, чтобы разбить колбу.По-другому вы можете предотвратить эту реакцию, поместив мерную колбу в баню со льдом и добавляя кислоту в дистиллированную воду. Лед будет поглощать энергию, выделяемую раствором, в результате чего раствор охлаждается.
Чтобы узнать, как приготовить раствор из твердого вещества, нажмите здесь.
Приготовление растворов в лаборатории | Общие лабораторные методы
Приготовление растворов является важной процедурой практически во всех биологических и химических экспериментах, проводимых по всему миру.
Раствор состоит из вещества, растворенного в жидкости. Растворенное вещество известно как растворенное вещество, а основная жидкость — как растворитель. Полученная гомогенная смесь называется раствором.
Растворы можно описать по концентрации растворенных веществ, показывая, сколько растворенного вещества присутствует на единицу раствора.
Создание растворов может быть базовым лабораторным навыком, но неправильная техника может означать разницу между успешным или неудачным экспериментом.
Первое, что нужно учитывать при принятии решений, — это безопасность. Важно принять соответствующие меры предосторожности, такие как ношение перчаток и лабораторного халата, в зависимости от типа химических веществ, с которыми вы работаете.
Есть много разных способов найти решение. Это видео продемонстрирует наиболее распространенный способ приготовления раствора на водной основе.
Сначала определите количество молей растворенного вещества, необходимое для достижения желаемой концентрации в заданном объеме раствора.Затем конвертируйте это значение в граммы, используя молекулярную массу или количество граммов на моль химического вещества.
Химические вещества можно взвесить с помощью цифровых весов и весовой лодки.
Затем можно использовать градуированный цилиндр для измерения объема очищенной воды, который составляет примерно три четверти конечного объема раствора.
Крайне важно, чтобы водные растворы готовились на очищенной воде, а не на водопроводной. Невыполнение этого требования может поставить под угрозу качество не только решения, но и, возможно, нескольких последующих экспериментов.
В этот момент очищенную воду следует перелить в химический стакан с мешалкой на магнитной мешалке.
Затем измеренные растворенные вещества можно добавить в очищенную воду при перемешивании. Перемешивание смеси способствует растворению растворенного вещества. Для этой цели также можно использовать тепло.
После растворения всех растворенных веществ в растворителе можно отрегулировать рН раствора с помощью рН-метра. Чтобы поднять рН, добавьте к перемешиваемому раствору разбавленный гидроксид натрия.Чтобы снизить рН, добавьте разбавленную соляную кислоту. Добавляйте кислоту или основание медленно, так как pH может быстро меняться.
pH-бумагу
также можно использовать для измерения pH раствора, однако использование откалиброванного pH-метра обеспечивает более точное измерение.
Затем раствор переливают в мерную колбу с помощью воронки, чтобы можно было довести его до конечного объема. Добавление количества, достаточного для достижения этого объема, известно как QS-решение.
Убедитесь, что мениск совпадает с отметкой на мерной колбе.В водном растворе мениск вогнутый, и его следует считывать в самой нижней точке кривой.
При проведении биологических исследований, особенно с участием живых клеток, может потребоваться стерилизация растворов перед использованием. Это можно сделать с помощью автоклавирования, при котором раствор подвергается воздействию пара высокой температуры под высоким давлением.
В качестве альтернативы раствор можно стерилизовать, пропуская через фильтр с размером пор 0,22 микрона, что исключает любые бактериальные клетки.
Теперь, когда у вас есть базовые знания о том, как делать растворы, пришло время взглянуть на некоторые часто используемые растворы в лаборатории и их применение.
В биологических исследованиях разрабатываются многочисленные растворы, имитирующие физиологические жидкости. Эти растворы забуферены, что означает, что они устойчивы к изменению pH в определенном диапазоне; обычно рН поддерживают на уровне около 7,4 для имитации внутриклеточной и внеклеточной жидкости.
Эти растворы забуферены, что означает, что они устойчивы к изменению pH в определенном диапазоне; обычно рН поддерживают на уровне около 7,4 для имитации внутриклеточной и внеклеточной жидкости.
Фосфатно-солевой буфер, или PBS, является широко используемым буфером в биологических исследованиях, который имитирует физиологический pH и осмолярность. Осмолярность относится к общему количеству молей растворенного вещества в растворе. Например, раствор, содержащий 1 моль NaCl, имеет 2 осмоля растворенного вещества, потому что ионы натрия и хлорида диссоциируют в растворе.PBS имеет концентрацию ионов, которая близко соответствует таковой в клетках, что делает его изотоническим раствором, а это означает, что количество растворенного вещества вне клетки эквивалентно тому, что находится внутри клетки. PBS состоит из нескольких различных солей в воде, включая соли с фосфатными группами, которые поддерживают постоянный pH в диапазоне от 7,2 до 7,6.
Обычное использование PBS в лаборатории включает промывание клеток и разбавление биомолекул, таких как белок.
Искусственная спинномозговая жидкость или ACSF имитирует концентрацию электролитов в спинномозговой жидкости.Этот раствор должен быть свежеприготовленным, а pH, осмолярность и ионный состав должны тщательно контролироваться, чтобы соответствовать условиям in vivo.
ACSF обычно используется в электрофизиологических исследованиях для приготовления срезов головного мозга и их перфузии во время экспериментов. Он также может служить внеклеточным раствором во время измерения пэтч-клэмп.
Раствор Рингера
представляет собой изотонический солевой раствор со сбалансированным pH, используемый в биологических исследованиях. Он обычно используется в экспериментах in vitro с органами и тканями.
Вы только что посмотрели введение JoVE в создание решений. В этом видео мы рассмотрели, как приготовить раствор от начала до конца… в том числе, как определить необходимое количество растворенного вещества (A), как правильно обеспечить качество раствора (B) и методы стерилизации (C). Мы также рассмотрели некоторые распространенные решения, а также их применение в биологических исследованиях (D).
Мы также рассмотрели некоторые распространенные решения, а также их применение в биологических исследованиях (D).
Спасибо за просмотр, и не забывайте всегда использовать правильную технику при принятии решений.
Требуется подписка.Пожалуйста, порекомендуйте JoVE вашему библиотекарю.
Как приготовить раствор моющего средства
В. Я делаю 1% раствор моющего средства? Как мне это сделать?
А. Спасибо за вопрос. Время от времени мы получаем такие звонки, и, безусловно, лучше быть уверенным, что . Большинство наших моющих средств рекомендуются при концентрации 1-2%. Концентрация напрямую связана с производительностью или количеством остатков, которые моющее средство может удалить. Более сильно загрязненные изделия требуют более высокой концентрации.У нас есть особенно сложные или прилипшие остатки, которые мы рекомендуем 3-5% или выше.
При приготовлении раствора моющего средства (1%) из порошкообразного моющего средства, такого как Alconox® Powdered Precision Cleaner или Tergazyme® Enzyme-Active порошкообразное моющее средство, вы можете делать свои растворы по весу или по объему.
Для приготовления растворов по весу добавьте либо 1,25 сухой унции порошка на 1 галлон воды, либо добавьте 10 граммов порошка на 1 литр воды. Кроме того, вы можете добавить мерную ложку на 1 унцию (обычно подойдет большая мерная ложка для кофе) на 1 галлон воды или добавить 2 столовые ложки порошка с горкой на 1 литр воды.Осторожно перемешайте в течение 1-2 минут, пока весь порошок не растворится.
В качестве альтернативы, чтобы приготовить объемные растворы с жидкими концентратами, такими как Liquinox® Critical Cleaning Liquid Detergent, добавьте 1,25 унции жидкости на 1 галлон воды или 10 мл жидкости на 1 литр воды и осторожно перемешайте в течение 10–15 секунд. . Все эти методы позволяют получить примерно 1% раствор для эффективной очистки. (Для концентрации 2% вы просто удвоите количество моющего средства, сохраняя при этом постоянный объем.)
Обратите внимание, что если требуется наивысшая точность процентного содержания моющего средства, вам придется учитывать общий объем при составлении рецептуры. Добавление 10 мл жидкого концентрата к 1 литру даст объем раствора 1010 мл. Если вы хотите получить точно из 1 литра 1% раствора Liquinox, вы должны добавить 9,9 мл к 990,1 мл воды. Подробнее см. в разделе «Точность разбавления при измерении концентрации».
Добавление 10 мл жидкого концентрата к 1 литру даст объем раствора 1010 мл. Если вы хотите получить точно из 1 литра 1% раствора Liquinox, вы должны добавить 9,9 мл к 990,1 мл воды. Подробнее см. в разделе «Точность разбавления при измерении концентрации».
Для запроса этих или любых других продуктов Alconox Inc.моющие средства бесплатно, пожалуйста, заполните анкету на Get Sample. Для получения дополнительной информации о любом из наших моющих средств Alconox Inc. обратитесь к техническому бюллетеню для каждого продукта. Или нажмите здесь, чтобы получить доступ к каждому из паспортов безопасности наших моющих средств.
У вас есть важный вопрос по очистке для экспертов Alconox Inc.? Поищите в TechNotes , чтобы узнать, был ли ответ на этот вопрос раньше, или Спросите у Alconox.
Свяжитесь с нами в любое время: cleaning@alconox.com
Глава 7 – Растворы – Химия
Глава 7: Растворы A Стехиометрия nd Solution
7. 1 Введение
1 Введение
7.2 Типы растворов
7.3 Растворимость
7.4 Температура и растворимость
7.5 Влияние давления на растворимость газов: закон Генри
7.6 Твердые гидраты
7.7 Концентрация раствора
7.7.1 Молярность
7.7.2 Частей на раствор
7.8 Разведения
7.9 Концентрация ионов в растворе
7.10 Окружающая среда: загрязнение свинцом
7.11 Резюме
7.12 Каталожные номера
7.1 Введение:
Напомним из главы 1, что растворы определяются как гомогенные смеси, которые перемешаны настолько тщательно, что ни один из компонентов не может наблюдаться независимо от другого. Решения вокруг нас. Воздух, например, является раствором.Если вы живете рядом с озером, рекой или океаном, этот водоем не чистый H 2 O, а, скорее всего, раствор. Многое из того, что мы пьем, например газированные напитки, кофе, чай и молоко, — это растворы. Решения составляют большую часть повседневной жизни. Многие химические процессы, происходящие вокруг нас, происходят в растворе. На самом деле большая часть химических процессов, происходящих в нашем организме, происходит в растворе, и многие растворы, такие как раствор лактата Рингера для внутривенного введения, важны в здравоохранении. В нашем понимании химии нам нужно немного понимать растворы.В этой главе вы узнаете об особых характеристиках растворов, о том, как они характеризуются, и о некоторых их свойствах.
Решения вокруг нас. Воздух, например, является раствором.Если вы живете рядом с озером, рекой или океаном, этот водоем не чистый H 2 O, а, скорее всего, раствор. Многое из того, что мы пьем, например газированные напитки, кофе, чай и молоко, — это растворы. Решения составляют большую часть повседневной жизни. Многие химические процессы, происходящие вокруг нас, происходят в растворе. На самом деле большая часть химических процессов, происходящих в нашем организме, происходит в растворе, и многие растворы, такие как раствор лактата Рингера для внутривенного введения, важны в здравоохранении. В нашем понимании химии нам нужно немного понимать растворы.В этой главе вы узнаете об особых характеристиках растворов, о том, как они характеризуются, и о некоторых их свойствах.
Навыки для развития
- Дайте определение этим терминам: раствор, растворенное вещество и растворитель.
- Различают растворы, смеси и коллоиды.
- Описать различные типы растворов.

- Различают ненасыщенные, насыщенные и пересыщенные растворы.
Основной компонент раствора называется растворителем , а второстепенный компонент(ы) называется растворенным веществом .Если оба компонента в растворе составляют 50%, термин растворенное вещество может быть присвоен любому компоненту. Когда газообразный или твердый материал растворяется в жидкости, газ или твердый материал называют растворенным веществом. Когда две жидкости растворяются друг в друге, главный компонент называется растворителем , а второстепенный компонент называется растворенным веществом .
В растворах протекают многие химические реакции, и растворы также тесно связаны с нашей повседневной жизнью.Воздух, которым мы дышим, жидкости, которые мы пьем, и жидкости в нашем теле — все это растворы. Кроме того, нас окружают такие решения, как воздух и вода (в реках, озерах и океанах).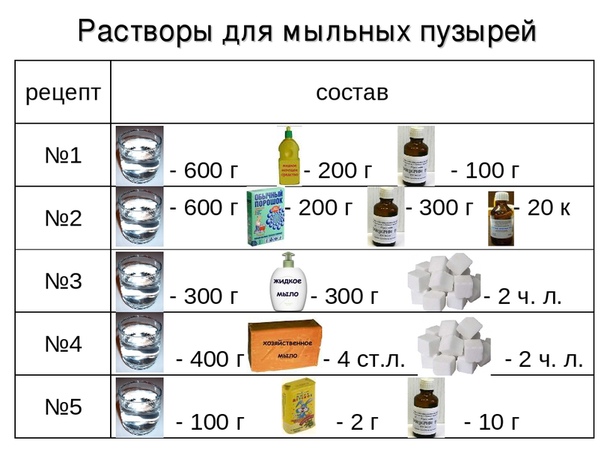
В тему решений мы включаем следующие разделы.
- Типы растворов: газообразные, жидкие и твердые растворы основаны на состояниях раствора.
- Стехиометрия раствора: выражение концентрации в различных единицах (масса на единицу объема, моль на единицу объема, проценты и доли), расчет стехиометрии реакции с участием растворов.
- Растворы электролитов: растворы кислот, оснований и солей, в которых растворенные вещества диссоциируют на положительные и отрицательные гидратированные ионы.
- Метатезис или реакции обмена: реакция электролитов, приводящая к нейтральным молекулам, газам и твердым веществам.
Решение задач стехиометрии растворов требует понятий, введенных в стехиометрию в главе 6, которая также обеспечивает основу для обсуждения реакций.
(наверх)
7.2 типа решений
В главе 1 вы познакомились с концепцией смеси , которая представляет собой вещество, состоящее из двух или более веществ. Напомним, что смеси могут быть двух типов: гомогенные и гетерогенные, где гомогенные смеси сочетаются настолько тесно, что их можно наблюдать как единое вещество, даже если это не так. С другой стороны, гетерогенные смеси неоднородны и имеют области смеси, которые выглядят иначе, чем другие области смеси.Гомогенные смеси можно разделить на две категории: коллоиды и растворы. Коллоид представляет собой смесь, которая содержит частицы диаметром от 2 до 500 нм. Коллоиды кажутся однородными по своей природе и имеют одинаковый состав, но они мутные или непрозрачные. Молоко является хорошим примером коллоида. Истинные растворы имеют размеры частиц типичного иона или небольшой молекулы (диаметром от ~ 0,1 до 2 нм) и прозрачны, хотя могут быть окрашены. В этой главе основное внимание будет уделено характеристикам истинных решений.
Напомним, что смеси могут быть двух типов: гомогенные и гетерогенные, где гомогенные смеси сочетаются настолько тесно, что их можно наблюдать как единое вещество, даже если это не так. С другой стороны, гетерогенные смеси неоднородны и имеют области смеси, которые выглядят иначе, чем другие области смеси.Гомогенные смеси можно разделить на две категории: коллоиды и растворы. Коллоид представляет собой смесь, которая содержит частицы диаметром от 2 до 500 нм. Коллоиды кажутся однородными по своей природе и имеют одинаковый состав, но они мутные или непрозрачные. Молоко является хорошим примером коллоида. Истинные растворы имеют размеры частиц типичного иона или небольшой молекулы (диаметром от ~ 0,1 до 2 нм) и прозрачны, хотя могут быть окрашены. В этой главе основное внимание будет уделено характеристикам истинных решений.
Материал существует в трех состояниях: твердом, жидком и газообразном. Решения также существуют во всех этих состояниях:
- Газовые смеси обычно гомогенны и обычно представляют собой растворы газ-газ .
 Для количественной обработки этого типа растворов мы посвятим единицу газам. Атмосфера представляет собой газообразный раствор, состоящий из азота, кислорода, аргона, углекислого газа, воды, метана и некоторых других второстепенных компонентов. Некоторые из этих компонентов, такие как вода, кислород и углекислый газ, могут различаться по концентрации в разных местах на Земле в зависимости от таких факторов, как температура и высота над уровнем моря.
Для количественной обработки этого типа растворов мы посвятим единицу газам. Атмосфера представляет собой газообразный раствор, состоящий из азота, кислорода, аргона, углекислого газа, воды, метана и некоторых других второстепенных компонентов. Некоторые из этих компонентов, такие как вода, кислород и углекислый газ, могут различаться по концентрации в разных местах на Земле в зависимости от таких факторов, как температура и высота над уровнем моря. - Когда молекулы газа, твердого тела или жидкости диспергированы и смешиваются с молекулами жидкости, гомогенные (однородные) состояния называются жидкими растворами . Твердые вещества, жидкости и газы растворяются в жидком растворителе с образованием жидких растворов. В этой главе большая часть химии, которую мы обсудим, происходит в жидких растворах, где растворителем является вода.
- Многие сплавы, керамика и полимерные смеси представляют собой твердые растворы . В определенных пределах медь и цинк растворяются друг в друге и затвердевают, образуя твердые растворы, называемые латунью.
 Серебро, золото и медь образуют множество различных сплавов с уникальными цветами и внешним видом. Сплавы и другие твердые растворы играют важную роль в мире химии материалов.
Серебро, золото и медь образуют множество различных сплавов с уникальными цветами и внешним видом. Сплавы и другие твердые растворы играют важную роль в мире химии материалов.
(наверх)
7.3 Растворимость
Максимальное количество вещества, которое может быть растворено в данном объеме растворителя, называется растворимостью . Часто растворимость в воде выражается в граммах на 100 мл. Раствор, не достигший максимальной растворимости, называется ненасыщенным раствором. Это означает, что в растворитель можно добавить больше растворенного вещества, и растворение все равно будет происходить.
Раствор, достигший максимальной растворимости, называется насыщенным раствором . Если в этот момент добавить больше растворенного вещества, оно не растворится в растворе. Вместо этого он останется осажденным в виде твердого вещества на дне раствора. Таким образом, часто можно сказать, что раствор насыщен, если присутствует дополнительное растворенное вещество (это может существовать в виде другой фазы, такой как газ, жидкость или твердое вещество).В насыщенном растворе нет чистого изменения количества растворенного вещества, но система ни в коем случае не статична. На самом деле растворенное вещество постоянно растворяется и осаждается с одинаковой скоростью. Такое явление называется равновесием . Например:
Таким образом, часто можно сказать, что раствор насыщен, если присутствует дополнительное растворенное вещество (это может существовать в виде другой фазы, такой как газ, жидкость или твердое вещество).В насыщенном растворе нет чистого изменения количества растворенного вещества, но система ни в коем случае не статична. На самом деле растворенное вещество постоянно растворяется и осаждается с одинаковой скоростью. Такое явление называется равновесием . Например:
В особых случаях раствор может быть перенасыщенным . Перенасыщенные растворы – это растворы, в которых содержание растворенного вещества превышает нормальную точку насыщения.Обычно для создания пересыщенного раствора требуется такое условие, как повышенная температура или давление. Например, ацетат натрия имеет очень высокую растворимость при 270 К. При охлаждении такой раствор остается растворенным в так называемом метастабильном состоянии . Однако при добавлении в раствор кристалла с затравкой дополнительное растворенное вещество быстро затвердевает. В процессе кристаллизации выделяется тепло, и раствор становится теплым. Обычные грелки для рук используют этот химический процесс для выработки тепла.
Однако при добавлении в раствор кристалла с затравкой дополнительное растворенное вещество быстро затвердевает. В процессе кристаллизации выделяется тепло, и раствор становится теплым. Обычные грелки для рук используют этот химический процесс для выработки тепла.
Видео 7.1: Видео, показывающее кристаллизацию пересыщенного раствора ацетата натрия. Видео: Школа естественных наук и математики Северной Каролины
Итак, как мы можем предсказать растворимость вещества?
Одной из полезных классификаций материалов является полярность. Когда вы читали о ковалентных и ионных соединениях в главах 3 и 4, вы узнали, что ионные соединения обладают самой высокой полярностью, образуя полные катионы и анионы внутри каждой молекулы, когда электроны передаются от одного атома к другому.Вы также узнали, что ковалентные связи могут быть полярными или неполярными по своей природе в зависимости от того, распределяют ли атомы, участвующие в связи, электроны неравно или поровну соответственно. Напомним, что по разнице электроотрицательностей можно определить полярность вещества. Обычно ионная связь имеет разность электроотрицательностей 1,8 или выше, тогда как полярная ковалентная связь составляет от 0,4 до 1,8, а неполярная ковалентная связь составляет 0,4 или ниже.
Напомним, что по разнице электроотрицательностей можно определить полярность вещества. Обычно ионная связь имеет разность электроотрицательностей 1,8 или выше, тогда как полярная ковалентная связь составляет от 0,4 до 1,8, а неполярная ковалентная связь составляет 0,4 или ниже.
Рис. 7.1 Диаграмма разницы электроотрицательности. На приведенной выше диаграмме показано, какой тип связи образуется между двумя разными атомами. Взяв разницу между значениями электроотрицательности для каждого из атомов, участвующих в связи, можно предсказать тип связи и полярность. Обратите внимание, что полный ионный характер достигается редко, однако, когда металлы и неметаллы образуют связи, они называются с использованием правил ионной связи.
Вещества с нулевой или низкой электроотгазнительностью, такими как H 2 , O 2 , N 2 , CCCl 4 , CCL 4 , CCL 4 — неволярных соединений , тогда как H 2 O, NH 3 , CH 3 OH, NO, CO, HCl, H 2 S, PH 3 более высокая разница электроотрицательности составляет полярных соединений . Обычно соединения с одинаковой полярностью растворимы друг в друге. Это можно описать правилом:
Обычно соединения с одинаковой полярностью растворимы друг в друге. Это можно описать правилом:
Подобное растворяется в подобном.
Это означает, что вещества должны иметь одинаковые межмолекулярные силы для образования растворов. Когда растворимое вещество вводится в растворитель, частицы растворенного вещества могут взаимодействовать с частицами растворителя. В случае твердого или жидкого растворенного вещества взаимодействия между частицами растворенного вещества и частицами растворителя настолько сильны, что отдельные частицы растворенного вещества отделяются друг от друга и, окруженные молекулами растворителя, входят в раствор.(Частицы газообразных растворенных веществ уже разделены, но концепция окружения частицами растворителя все еще применима.) Этот процесс называется solvatio n и проиллюстрирован на рис. 7.2. Когда растворителем является вода, используется слово гидратация , а не сольватация.
Обычно полярные растворители растворяют полярные растворенные вещества, тогда как неполярные растворители растворяют неполярные растворенные вещества. В целом процесс растворения зависит от силы притяжения между частицами растворенного вещества и частицами растворителя.Например, вода является высокополярным растворителем, способным растворять многие ионные соли. На рис. 7.2 показан процесс растворения, при котором вода действует как растворитель для растворения кристаллической соли хлорида натрия (NaCl). Обратите внимание, что когда ионные соединения растворяются в растворителе, они распадаются на свободно плавающие ионы в растворе. Это позволяет соединению взаимодействовать с растворителем. В случае растворения хлорида натрия в воде ион натрия притягивается к частичному отрицательному заряду атома кислорода в молекуле воды, тогда как ион хлорида притягивается к частично положительным атомам водорода.
Рисунок 7.2: Процесс растворения. Когда ионная соль, такая как хлорид натрия, показанная на (A), вступает в контакт с водой, молекулы воды диссоциируют ионные молекулы хлорида натрия в их ионное состояние, показанное в качестве молекулярной модели на (B) твердом теле. кристаллическая решетка хлорида натрия, и (С) хлорид натрия, растворенный в водном растворителе. (Фотография хлорида натрия предоставлена Крисом 73 ).
кристаллическая решетка хлорида натрия, и (С) хлорид натрия, растворенный в водном растворителе. (Фотография хлорида натрия предоставлена Крисом 73 ).
Многие ионные соединения растворимы в воде, однако не все ионные соединения растворимы.Ионные соединения, растворимые в воде, существуют в своем ионном состоянии в растворе. На рис. 7.2 вы заметите, что хлорид натрия распадается на ион натрия и ион хлорида по мере того, как он растворяется и взаимодействует с молекулами воды. Для ионных соединений, нерастворимых в воде, ионы настолько сильно притягиваются друг к другу, что не могут быть разделены парциальными зарядами молекул воды. Следующая таблица может помочь вам предсказать, какие ионные соединения будут растворимы в воде.
Таблица 7.1 Правила растворимости
Диссоциация растворимых ионных соединений придает растворам этих соединений интересное свойство: они проводят электричество. Из-за этого свойства растворимые ионные соединения называются электролитами . Многие ионные соединения полностью диссоциируют и поэтому называются сильными электролитами . Хлорид натрия является примером сильного электролита.Некоторые соединения растворяются, но диссоциируют лишь частично, и растворы таких растворенных веществ могут лишь слабо проводить электричество. Эти растворенные вещества называются слабыми электролитами . Уксусная кислота (CH 3 COOH), входящая в состав уксуса, является слабым электролитом. Растворенные вещества, растворяющиеся в отдельные нейтральные молекулы без диссоциации, не сообщают своим растворам дополнительной электропроводности и называются неэлектролитами . Полярные ковалентные соединения, такие как столовый сахар (C 12 H 22 O 11 ), являются хорошими примерами неэлектролитов .
Многие ионные соединения полностью диссоциируют и поэтому называются сильными электролитами . Хлорид натрия является примером сильного электролита.Некоторые соединения растворяются, но диссоциируют лишь частично, и растворы таких растворенных веществ могут лишь слабо проводить электричество. Эти растворенные вещества называются слабыми электролитами . Уксусная кислота (CH 3 COOH), входящая в состав уксуса, является слабым электролитом. Растворенные вещества, растворяющиеся в отдельные нейтральные молекулы без диссоциации, не сообщают своим растворам дополнительной электропроводности и называются неэлектролитами . Полярные ковалентные соединения, такие как столовый сахар (C 12 H 22 O 11 ), являются хорошими примерами неэлектролитов .
Термин электролит используется в медицине для обозначения любого из важных ионов, растворенных в водном растворе в организме. Важные физиологические электролиты включают Na + , K + , Ca 2 + , Mg 2 + и Cl —. Спортивные напитки, такие как Gatoraid, содержат комбинации этих ключевых электролитов, которые помогают восполнить потери электролитов после тяжелой тренировки.
Важные физиологические электролиты включают Na + , K + , Ca 2 + , Mg 2 + и Cl —. Спортивные напитки, такие как Gatoraid, содержат комбинации этих ключевых электролитов, которые помогают восполнить потери электролитов после тяжелой тренировки.
Точно так же можно приготовить растворы путем смешивания двух совместимых жидкостей.Жидкость с более низкой концентрацией называется растворенным веществом, , а жидкость с более высокой концентрацией — растворителем . Например, зерновой спирт (CH 3 CH 2 OH) представляет собой полярную ковалентную молекулу, которая может смешиваться с водой. Когда два аналогичных раствора помещаются вместе и могут смешаться в раствор, говорят, что они смешиваются . С другой стороны, жидкости, которые не обладают сходными характеристиками и не могут смешиваться друг с другом, называются несмешиваемыми . Например, масла, содержащиеся в оливковом масле, такие как олеиновая кислота (C 18 H 34 O 2 ), имеют в основном неполярные ковалентные связи, которые не имеют межмолекулярных сил, достаточно сильных, чтобы разорвать водородную связь между молекулы воды. Таким образом, вода и масло не смешиваются и считаются несмешиваемыми .
Например, масла, содержащиеся в оливковом масле, такие как олеиновая кислота (C 18 H 34 O 2 ), имеют в основном неполярные ковалентные связи, которые не имеют межмолекулярных сил, достаточно сильных, чтобы разорвать водородную связь между молекулы воды. Таким образом, вода и масло не смешиваются и считаются несмешиваемыми .
Другие факторы, такие как температура и давление, также влияют на растворимость растворителя. Таким образом, при указании растворимости следует также учитывать эти другие факторы.
(наверх)
7.4 Температура и растворимость
При рассмотрении растворимости твердых веществ зависимость температуры и растворимости не является простой или предсказуемой. На рис. 7.3 показаны зависимости растворимости некоторых органических и неорганических соединений в воде от температуры. Хотя растворимость твердого тела обычно увеличивается с повышением температуры, между строением вещества и температурной зависимостью его растворимости нет простой зависимости. Многие соединения (например, глюкоза и CH 3 CO 2 Na) демонстрируют резкое увеличение растворимости с повышением температуры. Другие (такие как NaCl и K 2 SO 4 ) демонстрируют небольшие изменения, а третьи (такие как Li 2 SO 4 ) становятся менее растворимыми с повышением температуры.
Многие соединения (например, глюкоза и CH 3 CO 2 Na) демонстрируют резкое увеличение растворимости с повышением температуры. Другие (такие как NaCl и K 2 SO 4 ) демонстрируют небольшие изменения, а третьи (такие как Li 2 SO 4 ) становятся менее растворимыми с повышением температуры.
Рис. 7.3 Растворимость некоторых неорганических и органических твердых веществ в воде в зависимости от температуры. Растворимость может увеличиваться или уменьшаться в зависимости от температуры; величина этой температурной зависимости широко варьируется среди соединений.
Изменение растворимости в зависимости от температуры было измерено для широкого круга соединений, и результаты опубликованы во многих стандартных справочниках. Химики часто могут использовать эту информацию для разделения компонентов смеси путем фракционной кристаллизации , разделения соединений на основе их растворимости в данном растворителе. Например, если у нас есть смесь 150 г ацетата натрия (CH 3 CO 2 Na) и 50 г KBr, мы можем разделить два соединения, растворив смесь в 100 г воды при 80°C. и затем медленно охлаждают раствор до 0°С.Согласно температурным кривым на рис. 7.3, оба соединения растворяются в воде при 80°С, а все 50 г KBr остаются в растворе при 0°С. Только около 36 г CH 3 CO 2 Na растворимы в 100 г воды при 0°C, поэтому примерно 114 г (150 г – 36 г) CH 3 CO 2 Na кристаллизуется. выходит на охлаждение. Затем кристаллы можно отделить фильтрованием. Таким образом, фракционная кристаллизация позволяет восстановить около 75% исходного CH 3 CO 2 Na в практически чистом виде всего за одну стадию.
Например, если у нас есть смесь 150 г ацетата натрия (CH 3 CO 2 Na) и 50 г KBr, мы можем разделить два соединения, растворив смесь в 100 г воды при 80°C. и затем медленно охлаждают раствор до 0°С.Согласно температурным кривым на рис. 7.3, оба соединения растворяются в воде при 80°С, а все 50 г KBr остаются в растворе при 0°С. Только около 36 г CH 3 CO 2 Na растворимы в 100 г воды при 0°C, поэтому примерно 114 г (150 г – 36 г) CH 3 CO 2 Na кристаллизуется. выходит на охлаждение. Затем кристаллы можно отделить фильтрованием. Таким образом, фракционная кристаллизация позволяет восстановить около 75% исходного CH 3 CO 2 Na в практически чистом виде всего за одну стадию.
Фракционная кристаллизация — это распространенный метод очистки самых разнообразных соединений, как показано на рис. 7.3, от антибиотиков до ферментов. Чтобы этот метод работал должным образом, исследуемое соединение должно быть более растворимым при высокой температуре, чем при низкой температуре, чтобы понижение температуры вызывало его кристаллизацию из раствора. Кроме того, примеси должны быть более растворимыми, чем интересующее соединение (как KBr в этом примере), и предпочтительно присутствовать в относительно небольших количествах.
Кроме того, примеси должны быть более растворимыми, чем интересующее соединение (как KBr в этом примере), и предпочтительно присутствовать в относительно небольших количествах.
Растворимость газов в жидкостях гораздо более предсказуема. Растворимость газов в жидкостях уменьшается с повышением температуры, как показано на рис. 7.4. Привлекательные межмолекулярные взаимодействия в газовой фазе практически равны нулю для большинства веществ, потому что молекулы находятся так далеко друг от друга, когда находятся в газообразной форме. Когда газ растворяется, это происходит потому, что его молекулы взаимодействуют с молекулами растворителя. Тепло высвобождается, когда формируются эти новые силы притяжения. Таким образом, если к системе добавляется внешнее тепло, оно преодолевает силы притяжения между газом и молекулами растворителя и снижает растворимость газа.
Рис. 7.4 Растворимость некоторых распространенных газов в воде в зависимости от температуры при парциальном давлении 1 атм. Растворимость газов уменьшается с повышением температуры.
Растворимость газов уменьшается с повышением температуры.
Уменьшение растворимости газов при более высоких температурах имеет как практические, так и экологические последствия. Любой, кто регулярно кипятит воду в чайнике или электрическом чайнике, знает, что внутри него образуется белый или серый налет, который в конечном итоге необходимо удалить.То же самое явление происходит в гораздо большем масштабе в гигантских котлах, используемых для подачи горячей воды или пара для промышленных целей, где оно называется «котловой накипью», отложением, которое может серьезно уменьшить пропускную способность труб горячей воды ( Рисунок 7.5). Проблема не только современная: акведуки, построенные римлянами 2000 лет назад для подачи холодной воды из альпийских регионов в более теплые и засушливые регионы на юге Франции, были забиты аналогичными отложениями. Химия образования этих отложений умеренно сложна, но движущей силой является потеря растворенного диоксида углерода (CO 2 ) из раствора. Жесткая вода содержит растворенные ионы Ca 2+ и HCO 3 − (бикарбонат). Гидрокарбонат кальция [Ca(HCO 3 ) 2 ] хорошо растворим в воде, а карбонат кальция (CaCO 3 ) совершенно нерастворим. Раствор бикарбонат-ионов может реагировать с образованием углекислого газа, карбонат-иона и воды:
Жесткая вода содержит растворенные ионы Ca 2+ и HCO 3 − (бикарбонат). Гидрокарбонат кальция [Ca(HCO 3 ) 2 ] хорошо растворим в воде, а карбонат кальция (CaCO 3 ) совершенно нерастворим. Раствор бикарбонат-ионов может реагировать с образованием углекислого газа, карбонат-иона и воды:
2HCO 3 − (водн.) → CO 2 2− (водн.) + H 2 O(л) + CO 2 (водн.)
Нагревание раствора снижает растворимость CO 2 , который уходит в газовую фазу над раствором.В присутствии ионов кальция ионы карбоната осаждаются в виде нерастворимого карбоната кальция, основного компонента накипи в котлах.
Рисунок 7.5 Накипь в водопроводной трубе. Карбонат кальция (CaCO 3 ) отложения в трубах горячей воды могут значительно уменьшить пропускную способность трубы. Эти отложения, называемые котловой накипью, образуются, когда растворенный CO 2 переходит в газовую фазу при высоких температурах.
В тепловом загрязнении озерная или речная вода, используемая для охлаждения промышленного реактора или электростанции, возвращается в окружающую среду при более высокой температуре, чем обычно.Из-за пониженной растворимости O 2 при более высоких температурах (рис. 7.4) более теплая вода содержит меньше растворенного кислорода, чем вода, поступающая в установку. Рыбы и другие водные организмы, которым для жизни необходим растворенный кислород, могут буквально задохнуться, если концентрация кислорода в их среде обитания слишком низкая. Поскольку теплая, обедненная кислородом вода менее плотная, она имеет тенденцию плавать поверх более прохладной, плотной и богатой кислородом воды в озере или реке, образуя барьер, препятствующий растворению атмосферного кислорода.В конце концов, даже глубокие озера могут задохнуться, если проблема не будет решена. Кроме того, большинство рыб и других водных организмов, не относящихся к млекопитающим, хладнокровны, а это означает, что температура их тела такая же, как и температура окружающей среды. Температуры, значительно превышающие нормальный диапазон, могут привести к серьезному стрессу или даже смерти. Системы охлаждения для электростанций и других объектов должны быть спроектированы таким образом, чтобы свести к минимуму любое неблагоприятное воздействие на температуру окружающих водоемов.На северо-западе Тихого океана популяции лососевых чрезвычайно чувствительны к изменениям температуры воды. В пределах этой популяции оптимальная температура воды находится между 12,8 и 17,8 o C (55-65 o F). Помимо пониженного уровня кислорода, популяции лосося гораздо более восприимчивы к болезням, хищникам и паразитарным инфекциям при более высоких температурах воды. Таким образом, тепловое загрязнение и глобальное изменение климата создают реальные проблемы для выживания и сохранения этих видов.Для получения дополнительной информации о влиянии повышения температуры на популяции лососевых посетите публикацию State of Washington’s Focus Publication.
Температуры, значительно превышающие нормальный диапазон, могут привести к серьезному стрессу или даже смерти. Системы охлаждения для электростанций и других объектов должны быть спроектированы таким образом, чтобы свести к минимуму любое неблагоприятное воздействие на температуру окружающих водоемов.На северо-западе Тихого океана популяции лососевых чрезвычайно чувствительны к изменениям температуры воды. В пределах этой популяции оптимальная температура воды находится между 12,8 и 17,8 o C (55-65 o F). Помимо пониженного уровня кислорода, популяции лосося гораздо более восприимчивы к болезням, хищникам и паразитарным инфекциям при более высоких температурах воды. Таким образом, тепловое загрязнение и глобальное изменение климата создают реальные проблемы для выживания и сохранения этих видов.Для получения дополнительной информации о влиянии повышения температуры на популяции лососевых посетите публикацию State of Washington’s Focus Publication.
Аналогичный эффект наблюдается в повышении температуры водоемов, таких как Чесапикский залив, крупнейший эстуарий в Северной Америке, причиной которого считается глобальное потепление. На каждые 1,5°C, на которые нагревается вода залива, способность воды растворять кислород уменьшается примерно на 1,1%. Многие морские виды, находящиеся на южной границе своего распространения, сместили свои популяции дальше на север.В 2005 году морская трава, которая является важной средой обитания для рыб и моллюсков, исчезла на большей части залива из-за рекордно высоких температур воды. Предположительно, снижение уровня кислорода уменьшило популяцию моллюсков и других фильтраторов, что затем уменьшило светопропускание, чтобы позволить расти взморникам. Сложные отношения в таких экосистемах, как Чесапикский залив, особенно чувствительны к колебаниям температуры, которые вызывают ухудшение качества среды обитания.
На каждые 1,5°C, на которые нагревается вода залива, способность воды растворять кислород уменьшается примерно на 1,1%. Многие морские виды, находящиеся на южной границе своего распространения, сместили свои популяции дальше на север.В 2005 году морская трава, которая является важной средой обитания для рыб и моллюсков, исчезла на большей части залива из-за рекордно высоких температур воды. Предположительно, снижение уровня кислорода уменьшило популяцию моллюсков и других фильтраторов, что затем уменьшило светопропускание, чтобы позволить расти взморникам. Сложные отношения в таких экосистемах, как Чесапикский залив, особенно чувствительны к колебаниям температуры, которые вызывают ухудшение качества среды обитания.
(наверх)
7.5 Влияние давления на растворимость газов: закон Генри
Внешнее давление очень мало влияет на растворимость жидкостей и твердых веществ. Напротив, растворимость газов увеличивается по мере увеличения парциального давления газа над раствором. Этот момент показан на рис. 7.6, где показано влияние повышенного давления на динамическое равновесие, которое устанавливается между молекулами растворенного газа в растворе и молекулами в газовой фазе над раствором.Поскольку концентрация молекул в газовой фазе увеличивается с ростом давления, концентрация молекул растворенного газа в равновесном растворе также выше при более высоких давлениях.
Этот момент показан на рис. 7.6, где показано влияние повышенного давления на динамическое равновесие, которое устанавливается между молекулами растворенного газа в растворе и молекулами в газовой фазе над раствором.Поскольку концентрация молекул в газовой фазе увеличивается с ростом давления, концентрация молекул растворенного газа в равновесном растворе также выше при более высоких давлениях.
Рис. 7.6. Модель, показывающая, почему растворимость газа увеличивается по мере увеличения парциального давления при постоянной температуре. (а) Когда газ вступает в контакт с чистой жидкостью, некоторые молекулы газа (фиолетовые сферы) сталкиваются с поверхностью жидкости и растворяются.Когда концентрация растворенных молекул газа увеличилась настолько, что скорость, с которой молекулы газа уходят в газовую фазу, стала такой же, как скорость, с которой они растворяются, установилось динамическое равновесие, как показано здесь. (б) Увеличение давления газа увеличивает количество молекул газа в единице объема, что увеличивает скорость, с которой молекулы газа сталкиваются с поверхностью жидкости и растворяются. (c) По мере растворения дополнительных молекул газа при более высоком давлении концентрация растворенного газа увеличивается до тех пор, пока не установится новое динамическое равновесие.
(c) По мере растворения дополнительных молекул газа при более высоком давлении концентрация растворенного газа увеличивается до тех пор, пока не установится новое динамическое равновесие.
Связь между давлением и растворимостью газа количественно описывается законом Генри, названным в честь его первооткрывателя, английского врача и химика Уильяма Генри (1775–1836):
C = кПа
, где C — концентрация растворенного газа в равновесии, P — парциальное давление газа, а k — константа закона Генри , которую необходимо определить экспериментально для каждой комбинации газа, растворителя, и температура.Хотя концентрацию газа можно выразить в любых удобных единицах, мы будем использовать исключительно молярность. Таким образом, единицами константы закона Генри являются моль/(л·атм) = М/атм. Значения констант закона Генри для растворов некоторых газов в воде при 20°C приведены в таблице 7. 2
2
Видеоруководство по закону Генри от Академии Кана
Все материалы Академии Хана доступны бесплатно на сайте www.khanacademy.org
Как данные в таблице 7.2 видно, что концентрация растворенного газа в воде при данном давлении сильно зависит от ее физических свойств. Для ряда родственных веществ лондоновские дисперсионные силы увеличиваются с увеличением молекулярной массы. Таким образом, среди элементов группы 18 константы закона Генри плавно возрастают от He к Ne и к Ar. Таблица также показывает, что растворимость O 2 почти в два раза выше, чем у N 2 . Хотя лондонские дисперсионные силы слишком слабы, чтобы объяснить такую большую разницу, O 2 является парамагнитным и, следовательно, более поляризуемым, чем N 2 , что объясняет его высокую растворимость.(Примечание: когда вещество парамагнитно оно очень слабо притягивается полюсами магнита, но не сохраняет какого-либо постоянного магнетизма).
Таблица 7.2 Константы закона Генри для некоторых газов в воде при 20°C
Парциальное давление газа можно выразить как концентрацию, записав закон Генри как P газ = C /k. Это важно во многих аспектах жизни, включая медицину, где обычно измеряют газы крови, такие как кислород и углекислый газ.Поскольку парциальное давление и концентрация прямо пропорциональны, если парциальное давление газа изменяется, а температура остается постоянной, новую концентрацию газа в жидкости можно легко рассчитать с помощью следующего уравнения:
Где C 1 и P 1 — концентрация и парциальное давление соответственно газа в начальных условиях, а C 2 и P 2 9012 — концентрация и парциальное давление соответственно газа в конечном состоянии.Например:
Практическая задача: Концентрация CO 2 в растворе составляет 0,032 М при 3,0 атм. Какова концентрация CO 2 при давлении 5,0 атм?
Какова концентрация CO 2 при давлении 5,0 атм?
Решение: Чтобы решить эту проблему, сначала мы должны определить, что мы хотим найти. Это концентрация CO 2 при давлении 5,0 атм. Эти два значения представляют C 2 = ?? и P 2 = 5.0 атм. В этот момент будет проще всего изменить наше уравнение выше, чтобы найти C 2 . Далее нам нужно определить начальные условия, C 1 = 0,032 M и P 1 = 3,0 атм. Затем мы можем подставить эти значения в уравнение и найти C 2 :
Газы, химически реагирующие с водой, такие как HCl и другие галогеноводороды, H 2 S и NH 3 , не подчиняются закону Генри; все эти газы гораздо более растворимы, чем предсказывает закон Генри.Например, HCl реагирует с водой с образованием H + (водн. ) и Cl — (водн.), , а не растворенных молекул HCl, и его диссоциация на ионы приводит к гораздо более высокой растворимости, чем ожидалось для нейтральной молекулы. В целом, газы, реагирующие с водой, не подчиняются закону Генри.
) и Cl — (водн.), , а не растворенных молекул HCl, и его диссоциация на ионы приводит к гораздо более высокой растворимости, чем ожидалось для нейтральной молекулы. В целом, газы, реагирующие с водой, не подчиняются закону Генри.
Обратите внимание на шаблон
Закон Генри имеет важные применения. Например, пузырьки CO 2 образуются, как только открывается газированный напиток, потому что напиток был разлит в бутылки под CO 2 при давлении более 1 атм.Когда бутылку открывают, давление CO 2 над раствором быстро падает, и часть растворенного газа выходит из раствора в виде пузырьков. Закон Генри также объясняет, почему аквалангисты должны быть осторожны, чтобы медленно всплывать на поверхность после погружения, если они дышат сжатым воздухом. При более высоких давлениях под водой большее количество N 2 из воздуха растворяется во внутренних жидкостях водолаза. Если дайвер всплывает слишком быстро, быстрое изменение давления вызывает образование маленьких пузырьков N 2 по всему телу, состояние, известное как «изгибы».Эти пузырьки могут блокировать поток крови через мелкие кровеносные сосуды, вызывая сильную боль и даже приводя к летальному исходу в некоторых случаях.
Если дайвер всплывает слишком быстро, быстрое изменение давления вызывает образование маленьких пузырьков N 2 по всему телу, состояние, известное как «изгибы».Эти пузырьки могут блокировать поток крови через мелкие кровеносные сосуды, вызывая сильную боль и даже приводя к летальному исходу в некоторых случаях.
Из-за низкой константы закона Генри для O 2 в воде уровни растворенного кислорода в воде слишком низки для удовлетворения энергетических потребностей многоклеточных организмов, включая человека. Для повышения концентрации O 2 во внутренних жидкостях организмы синтезируют легкорастворимые молекулы-носители, обратимо связывающие O 2 . Например, эритроциты человека содержат белок, называемый гемоглобином, который специфически связывает O 2 и облегчает его транспортировку из легких в ткани, где он используется для окисления молекул пищи для получения энергии.Концентрация гемоглобина в нормальной крови составляет около 2,2 мМ, и каждая молекула гемоглобина может связывать четыре молекулы O 2 . Хотя концентрация растворенного O 2 в сыворотке крови при 37°C (нормальная температура тела) составляет всего 0,010 мМ, общая растворенная концентрация O 2 составляет 8,8 мМ, что почти в тысячу раз больше, чем было бы возможно без гемоглобина. Синтетические переносчики кислорода на основе фторированных алканов были разработаны для использования в качестве экстренной замены цельной крови.В отличие от донорской крови эти «кровезаменители» не требуют охлаждения и имеют длительный срок хранения. Их очень высокие константы закона Генри для O 2 приводят к концентрации растворенного кислорода, сравнимой с таковой в нормальной крови.
Хотя концентрация растворенного O 2 в сыворотке крови при 37°C (нормальная температура тела) составляет всего 0,010 мМ, общая растворенная концентрация O 2 составляет 8,8 мМ, что почти в тысячу раз больше, чем было бы возможно без гемоглобина. Синтетические переносчики кислорода на основе фторированных алканов были разработаны для использования в качестве экстренной замены цельной крови.В отличие от донорской крови эти «кровезаменители» не требуют охлаждения и имеют длительный срок хранения. Их очень высокие константы закона Генри для O 2 приводят к концентрации растворенного кислорода, сравнимой с таковой в нормальной крови.
(наверх)
7.6 Твердые гидраты:
Некоторые ионные твердые тела принимают небольшое количество молекул воды в свою структуру кристаллической решетки и остаются в твердом состоянии.Эти твердые вещества называются твердыми гидратами . Твердые гидраты содержат соединенные в определенном соотношении молекулы воды как неотъемлемую часть кристалла, либо связанные с металлическим центром, либо кристаллизовавшиеся с металлокомплексом. Также говорят, что такие гидраты содержат кристаллизационную воду или гидратационную воду .
Твердые гидраты содержат соединенные в определенном соотношении молекулы воды как неотъемлемую часть кристалла, либо связанные с металлическим центром, либо кристаллизовавшиеся с металлокомплексом. Также говорят, что такие гидраты содержат кристаллизационную воду или гидратационную воду .
Ярким примером является хлорид кобальта (II), который при гидратации меняет цвет с синего на красный и поэтому может использоваться в качестве индикатора воды.
Рисунок 7.7: Хлорид кобальта как пример твердого гидрата. Безводный хлорид кобальта (вверху слева) и его структура кристаллической решетки (внизу слева) по сравнению с гексагидратом хлорида кобальта (вверху справа) и его кристаллической решеткой (внизу справа). Обратите внимание, что молекулы воды, показанные красным (кислород) и белым (водород), интегрированы в кристаллическую решетку хлорида кобальта (II), показанного синим (кобальт) и зеленым (хлорид), в зависимости от полярности. Частично отрицательные атомы кислорода притягиваются к положительно заряженному кобальту, а частично положительные атомы водорода притягиваются к отрицательно заряженным ионам хлора.Изображения предоставлены Wikipedia Commons (вверху слева и внизу слева), Benjah-bmm27 (вверху справа) и Smokefoot (внизу справа)
Частично отрицательные атомы кислорода притягиваются к положительно заряженному кобальту, а частично положительные атомы водорода притягиваются к отрицательно заряженным ионам хлора.Изображения предоставлены Wikipedia Commons (вверху слева и внизу слева), Benjah-bmm27 (вверху справа) и Smokefoot (внизу справа)
.
Обозначение, используемое для представления твердого гидрата: « гидратированное соединение ⋅ n H 2 O », где n — число молекул воды на формульную единицу соли. n обычно представляет собой небольшое целое число, хотя могут встречаться и дробные значения. Например, в моногидрате n равно единице, а в гексагидрате n равно 6.Например, на рис. 7.7 гидратированный хлорид кобальта будет обозначаться: «хлорид кобальта (II)⋅ 6 H 2 O». Числовые префиксы греческого происхождения, которые используются для обозначения твердых гидратов:
- Hemi – 1/2
- Моно – 1
- Полуторный – 1½
- Ди – 2
- Три – 3
- Тетра – 4
- Пента – 5
- Шестигранник – 6
- Гепта – 7
- Окта – 8
- Нона – 9
- Дека – 10
- Ундека – 11
- Додека – 12
Гидрат, потерявший воду, называется ангидридом ; оставшуюся воду, если она есть, можно удалить только при очень сильном нагревании. Вещество, не содержащее воды, называется безводным . Некоторые безводные соединения так легко гидратируются, что вытягивают воду из атмосферы и гидратируются. Эти вещества считаются гигроскопичными и могут использоваться в качестве осушителей или влагопоглотителей .
Вещество, не содержащее воды, называется безводным . Некоторые безводные соединения так легко гидратируются, что вытягивают воду из атмосферы и гидратируются. Эти вещества считаются гигроскопичными и могут использоваться в качестве осушителей или влагопоглотителей .
(наверх)
7.7 Концентрация раствора
В химии концентрация определяется как содержание компонента, деленное на общий объем смеси.У всех нас есть качественное представление о том, что подразумевается под концентрацией . Любой, кто готовил растворимый кофе или лимонад, знает, что слишком много порошка дает сильно ароматизированный, высококонцентрированный напиток, тогда как слишком мало дает разбавленный раствор, который трудно отличить от воды. Количественно концентрация раствора описывает количество растворенного вещества, которое содержится в конкретном количестве этого раствора. Знание концентрации растворенных веществ важно для контроля стехиометрии реагентов для реакций, происходящих в растворе, и имеет решающее значение для многих аспектов нашей жизни, от измерения правильной дозы лекарства до обнаружения химических загрязнителей, таких как свинец и мышьяк.Химики используют множество различных способов определения концентрации. В этом разделе мы рассмотрим наиболее распространенные способы представления концентрации раствора. К ним относятся: молярность и количество частей в растворе.
Знание концентрации растворенных веществ важно для контроля стехиометрии реагентов для реакций, происходящих в растворе, и имеет решающее значение для многих аспектов нашей жизни, от измерения правильной дозы лекарства до обнаружения химических загрязнителей, таких как свинец и мышьяк.Химики используют множество различных способов определения концентрации. В этом разделе мы рассмотрим наиболее распространенные способы представления концентрации раствора. К ним относятся: молярность и количество частей в растворе.
7.7.1 Молярность
Наиболее распространенной единицей концентрации является молярность , которая также наиболее полезна для расчетов, связанных со стехиометрией реакций в растворе. Молярность (M) раствора — это количество молей растворенного вещества, присутствующего ровно в 1 л раствора.
Таким образом, единицами молярности являются моли на литр раствора (моль/л), сокращенно М. Обратите внимание, что указанный объем является общим объемом раствора и включает как растворенное вещество, так и растворитель. Например, водный раствор, содержащий 1 моль (342 г) сахарозы в количестве воды, достаточном для получения конечного объема 1,00 л, имеет концентрацию сахарозы 1,00 моль/л или 1,00 М. В химических обозначениях квадратные скобки вокруг названия или формула растворенного вещества представляет собой концентрацию растворенного вещества.Итак,
Обратите внимание, что указанный объем является общим объемом раствора и включает как растворенное вещество, так и растворитель. Например, водный раствор, содержащий 1 моль (342 г) сахарозы в количестве воды, достаточном для получения конечного объема 1,00 л, имеет концентрацию сахарозы 1,00 моль/л или 1,00 М. В химических обозначениях квадратные скобки вокруг названия или формула растворенного вещества представляет собой концентрацию растворенного вещества.Итак,
[сахароза] = 1,00 М
читается как «концентрация сахарозы 1,00 молярная». Приведенное выше уравнение можно использовать для расчета количества растворенного вещества, необходимого для получения любого количества желаемого раствора.
Пример проблемы:
Рассчитайте количество молей гидроксида натрия (NaOH), необходимое для получения 2,50 л 0,100 М NaOH.
Дано: (1) идентичность растворенного вещества = NaOH, (2) объем = 2,50 л и (3) молярность раствора = 0. 100 моль/л (Примечание: при расчете задач всегда записывайте единицы молярности как моль/л, а не М. Это позволит вам сократить ваши единицы при расчете.)
100 моль/л (Примечание: при расчете задач всегда записывайте единицы молярности как моль/л, а не М. Это позволит вам сократить ваши единицы при расчете.)
Запрашиваемое: количество растворенного вещества в молях
Стратегия: (1) Измените приведенное выше уравнение, чтобы найти нужные единицы измерения, в данном случае моли. (2) Дважды проверьте все единицы измерения в уравнении и убедитесь, что они совпадают. Выполните любые необходимые преобразования, чтобы единицы измерения совпадали. (3) Правильно введите значения и посчитайте.
Решение:
(1) Измените приведенное выше уравнение, чтобы найти моли.
(2) Дважды проверьте все единицы измерения в уравнении и убедитесь, что они совпадают.
Данными значениями для этого уравнения являются объем 2,50 л и молярность 0,100 моль/л. Единицы объема для обоих этих чисел указаны в литрах (л) и, таким образом, совпадают. Поэтому никаких преобразований делать не нужно.
Поэтому никаких преобразований делать не нужно.
(3) Введите соответствующие значения и выполните расчеты.
Приготовление растворов
Обратите внимание, что в приведенном выше примере у нас по-прежнему недостаточно информации, чтобы действительно сделать раствор в лаборатории. Не существует прибора, который мог бы измерить количество молей вещества. Для этого нам нужно преобразовать количество молей образца в количество граммов, представленное этим числом. Затем мы можем легко использовать весы, чтобы взвесить количество вещества, необходимое для раствора.Для примера выше:
Чтобы приготовить раствор, растворенное вещество обычно растворяют в небольшом количестве растворителя, а затем, когда растворенное вещество растворяется, окончательный объем можно довести до 2,50 л. Если вы сразу добавили 10 г NaOH до 2,50 л, конечный объем будет больше 2,50 л, а концентрация раствора будет меньше 0,100 М. Помните, что конечный объем должен включать как растворенное вещество, так и растворитель.
На рис. 7.8 показана процедура приготовления раствора дигидрата хлорида кобальта(II) в этаноле.Обратите внимание, что объем растворителя не указан. Поскольку растворенное вещество занимает место в растворе, необходимый объем растворителя на 90 292 меньше, чем на 90 293 желаемого общего объема раствора.
Рисунок 7.8: Приготовление раствора известной концентрации с использованием твердого растворенного вещества. Чтобы приготовить раствор, начните с добавления части растворителя в колбу. Затем отмерьте необходимое количество растворенного вещества и медленно добавьте его в растворитель.После растворения в растворителе объем раствора можно довести до конечного объема раствора. Для показанной мерной колбы это обозначено черной линией на горлышке колбы. В данном случае это означает 500 мл раствора. Мерные колбы существуют разных размеров для разных объемов растворов. Градуированные цилиндры также можно использовать для точного доведения раствора до конечного объема. Другая стеклянная посуда, включая мензурки и колбы Эрленмейера, недостаточно точна для приготовления большинства растворов.
Другая стеклянная посуда, включая мензурки и колбы Эрленмейера, недостаточно точна для приготовления большинства растворов.
Пример расчета молярности
Раствор на рис. 7.8 содержит 10,0 г дигидрата хлорида кобальта(II), CoCl 2 ·2H 2 O, в этаноле, достаточном для получения ровно 500 мл раствора. Какова молярная концентрация CoCl 2 ·2H 2 O?
Дано: масса растворенного вещества и объем раствора
Запрашиваемый: концентрация (M)
Стратегия:
1.Мы знаем, что молярность равна молям на литр
.
2. Чтобы рассчитать молярность, нам нужно выразить:
- масса в виде кротов
- объем в литрах
- Подставьте оба значения в приведенное выше уравнение и вычислите
.
Решение:
- Преобразование массы в моли. Мы можем использовать молярную массу для преобразования граммов CoCl 2 · 2H 2 O в моли.

- Молярная масса CoCl 2 ·2H 2 O равна 165.87 г/моль (включая две молекулы воды, поскольку они являются частью структуры кристаллической решетки этого твердого гидрата!)
2. Преобразуйте объем в литры
3. Подставьте значения в уравнение молярности:
7.7.2 Частей на раствор
В потребительском и промышленном мире наиболее распространенный метод выражения концентрации основан на количестве растворенного вещества в фиксированном количестве раствора.Упомянутые здесь «количества» могут быть выражены в массе, в объеме или в том и другом (т. е. масса растворенного вещества в данном объеме раствора). Чтобы различать эти возможности, используются сокращения (m/ м), (об/об) и (м/об).
В большинстве прикладных областей химии часто используется мера (m/m), тогда как в клинической химии обычно используется (m/v), где масса выражается в граммах и объем в мл.
Один из наиболее распространенных способов выражения таких концентраций как « частей на 100 », который мы все знаем как « процентов ».« Cent » — префикс латинского происхождения, относящийся к числу 100
(L. centum ), например, или . Он также обозначает 1/100 (от L. центезимуса ), как в сантиметре и денежной единице цента . Процентные растворы определяют количество растворенного вещества, растворенного в количестве раствора, умноженное на 100. Процентные растворы могут быть выражены в единицах массы растворенного вещества на массу раствора (м/м) или массы растворенного вещества на объем раствора (м/м). об.%), или объем растворенного вещества на объем раствора (об./об.%).При приготовлении процентного раствора важно указать, какие единицы измерения используются, чтобы другие тоже могли правильно составить раствор. Кроме того, помните, что раствор представляет собой сумму растворителя и растворенного вещества, когда вы выполняете процентные вычисления.
Раствор = Раствор + Растворитель
Таким образом, при расчете процентных растворов можно использовать следующее уравнение:
Пример 1:
Например, 7,0% об/об раствор этанола в воде будет содержать 7 мл этанола в 100 мл раствора.Сколько воды в растворе?
В этой задаче мы знаем, что:
Раствор = растворенное вещество + растворитель
Таким образом, мы можем заполнить значения, а затем найти неизвестное.
100 мл = 7 мл + X мл растворителя (в данном случае вода)
переместив семерку на другую сторону, мы увидим, что:
100 мл – 7 мл = 93 мл H 2 O
Пример 2
Чему равно (масс./об.)% раствора, если 24.0 г сахарозы растворяют в общем растворе объемом 243 мл?
Пример 3
Сколько граммов NaCl требуется для приготовления 625 мл 13,5% раствора?
Для более разбавленных растворов используются части на миллион (10 6 ppm) и части на миллиард (10 9 ; ppb). Эти термины широко используются для выражения количества следовых загрязнителей в окружающей среде.
Эти термины широко используются для выражения количества следовых загрязнителей в окружающей среде.
Аналогично процентным единицам («частям на сотню»), ppm и ppb могут быть определены в виде масс, объемов или смешанных единиц масса-объем.Существуют также единицы ppm и ppb, определяемые по количеству атомов и молекул.
Массовые определения частей на миллион и частей на миллиард приведены здесь:
Как ppm, так и ppb являются удобными единицами измерения концентрации загрязняющих веществ и других следов загрязняющих веществ в воде. Концентрации этих загрязняющих веществ, как правило, очень низки в обработанных и природных водах, и их уровни не могут превышать относительно низкие пороговые концентрации, не оказывая неблагоприятного воздействия на здоровье и дикую природу.Например, Агентство по охране окружающей среды установило, что максимально безопасный уровень ионов фтора в водопроводной воде составляет 4 части на миллион. Проточные фильтры для воды предназначены для снижения концентрации фтора и некоторых других загрязняющих веществ в следовых количествах в водопроводной воде (рис. 7.9).
7.9).
Рисунок 7.9. (a) В некоторых районах следовые концентрации загрязняющих веществ могут сделать нефильтрованную водопроводную воду непригодной для питья и приготовления пищи. (b) Проточные фильтры для воды снижают концентрацию растворенных веществ в водопроводной воде.(кредит a: модификация работы Дженн Дерфи; кредит b: модификация работы «vastateparkstaff»/Wikimedia commons
При сообщении о таких загрязняющих веществах, как свинец в питьевой воде, концентрации ppm и ppb часто указываются в смешанных единицах измерения массы/объема. Это может быть очень полезно, поскольку нам легче думать о воде с точки зрения ее объема, а не ее массы. Кроме того, плотность воды составляет 1,0 г/мл или 1,0 мг/0,001 мл, что упрощает преобразование между двумя единицами измерения.Например, если мы обнаружим, что содержание свинца в воде составляет 4 части на миллион, это будет означать, что имеются:
7,74 Аналоги
Концентрации ионных растворенных веществ иногда выражают в единицах, называемых эквивалентами (уравнение). Один эквивалент равен 1 молю положительного или отрицательного заряда. Таким образом, 1 моль/л Na + (водн.) также равен 1 экв/л, поскольку натрий имеет заряд 1+. Раствор ионов Ca 2 + (водн.) с концентрацией 1 моль/л имеет концентрацию 2 экв/л, поскольку кальций имеет заряд 2+.Разбавленные растворы могут быть выражены в миллиэквивалентах (мэкв) — например, плазма крови человека имеет общую концентрацию около 150 мэкв/л.
Один эквивалент равен 1 молю положительного или отрицательного заряда. Таким образом, 1 моль/л Na + (водн.) также равен 1 экв/л, поскольку натрий имеет заряд 1+. Раствор ионов Ca 2 + (водн.) с концентрацией 1 моль/л имеет концентрацию 2 экв/л, поскольку кальций имеет заряд 2+.Разбавленные растворы могут быть выражены в миллиэквивалентах (мэкв) — например, плазма крови человека имеет общую концентрацию около 150 мэкв/л.
В более формальном определении эквивалент — это количество вещества, необходимое для выполнения одного из следующих действий:
- вступают в реакцию с одним молем ионов водорода (H + ) или выделяют один моль в кислотно-щелочной реакции
- реагируют или отдают один моль электронов в окислительно-восстановительной реакции.
Согласно этому определению, эквивалентно — это число молей иона в растворе, умноженное на валентность этого иона.Если 1 моль NaCl и 1 моль CaCl 2 растворяются в растворе, в этом растворе содержится 1 экв Na, 2 экв Ca и 3 экв Cl. (Валентность кальция равна 2, поэтому для этого иона у вас есть 1 моль и 2 эквивалента.)
(Валентность кальция равна 2, поэтому для этого иона у вас есть 1 моль и 2 эквивалента.)
(наверх)
7.8 Разведения
Раствор нужной концентрации также можно приготовить, разбавив небольшой объем более концентрированного раствора дополнительным растворителем. Для этой цели часто используют маточный раствор, представляющий собой приготовленный раствор известной концентрации.Разбавление маточного раствора предпочтительнее при приготовлении растворов очень слабых концентраций, потому что альтернативный метод взвешивания крошечных количеств растворенного вещества может быть трудным для выполнения с высокой степенью точности. Разбавление также используется для приготовления растворов из веществ, которые продаются в виде концентрированных водных растворов, таких как сильные кислоты.
Раствор нужной концентрации также можно приготовить, разбавив небольшой объем более концентрированного раствора дополнительным растворителем. Для этой цели часто используют маточный раствор, представляющий собой приготовленный раствор известной концентрации. Разбавление маточного раствора предпочтительнее при приготовлении растворов очень слабых концентраций, потому что альтернативный метод взвешивания крошечных количеств растворенного вещества может быть трудным для выполнения с высокой степенью точности. Разбавление также используется для приготовления растворов из веществ, которые продаются в виде концентрированных водных растворов, таких как сильные кислоты.
Для этой цели часто используют маточный раствор, представляющий собой приготовленный раствор известной концентрации. Разбавление маточного раствора предпочтительнее при приготовлении растворов очень слабых концентраций, потому что альтернативный метод взвешивания крошечных количеств растворенного вещества может быть трудным для выполнения с высокой степенью точности. Разбавление также используется для приготовления растворов из веществ, которые продаются в виде концентрированных водных растворов, таких как сильные кислоты.
Процедура приготовления раствора известной концентрации из исходного раствора показана на рисунке 7.10. Требуется вычислить желаемое количество растворенного вещества в конечном объеме более разбавленного раствора, а затем вычислить объем исходного раствора, содержащего это количество растворенного вещества. Помните, что разбавление заданного количества маточного раствора растворителем , а не изменяет количество присутствующего растворенного вещества, изменяется только объем раствора. Таким образом, соотношение между объемом и концентрацией исходного раствора и объемом и концентрацией желаемого разбавленного раствора может быть выражено математически как:
Таким образом, соотношение между объемом и концентрацией исходного раствора и объемом и концентрацией желаемого разбавленного раствора может быть выражено математически как:
Где M s — концентрация исходного раствора, V s — объем исходного раствора, M d — концентрация разбавленного раствора, а V d — объем разбавленного раствора. .
Рис. 7.10 Приготовление раствора известной концентрации путем разбавления маточного раствора. (a) Объем ( V s ), содержащий желаемое количество растворенного вещества (M s ), измеряется из маточного раствора известной концентрации. (b) Измеренный объем маточного раствора переносят во вторую мерную колбу. (c) Измеренный объем во второй колбе затем разбавляют растворителем до объемной метки ].
Пример расчета разбавления
Какой объем 3,00 М исходного раствора глюкозы необходим для приготовления 2500 мл 0,400 М раствора?
Дано: объем и молярность разбавленного раствора и молярность исходного раствора
Запрошено: объем маточного раствора
Стратегия и решение:
Для задач на разбавление, если вы знаете 3 переменные, вы можете решить для 4-й переменной.
- Начните с изменения уравнения для решения переменной, которую вы хотите найти. В этом случае необходимо найти объем маточного раствора, V s
2. Затем убедитесь, что одинаковые термины имеют одинаковые единицы измерения. Например, Md и Ms являются концентрациями, поэтому для выполнения расчетов они должны быть в одних и тех же единицах (в этом случае они оба указаны в молярности). Если бы концентрации были разными, скажем, один был указан в молярности, а другой в процентах, или один был в молярности, а другой в миллимолярности, один из терминов необходимо было бы преобразовать, чтобы они совпадали.Таким образом, в данном случае единицы измерения будут уравновешены, и вы останетесь с единицами объема.
3. Наконец, заполните уравнение известными значениями и рассчитайте окончательный ответ.
Обратите внимание, что если требуется 333 мл исходного раствора, вы также можете рассчитать количество растворителя, необходимого для окончательного разбавления. (Общий объем – объем исходного раствора = объем растворителя, необходимый для окончательного разбавления. В этом случае 2500 мл – 333 мл = 2167 мл воды, необходимой для окончательного разбавления (это следует делать в мерном цилиндре или мерной колбе). .
(Общий объем – объем исходного раствора = объем растворителя, необходимый для окончательного разбавления. В этом случае 2500 мл – 333 мл = 2167 мл воды, необходимой для окончательного разбавления (это следует делать в мерном цилиндре или мерной колбе). .
(наверх)
7.9 Концентрация ионов в растворе
До сих пор мы обсуждали концентрацию всего раствора в терминах общего количества растворенного вещества, деленного на объем раствора. Рассмотрим подробнее, что именно это означает при рассмотрении ионных и ковалентных соединений. Когда ионные соединения растворяются в растворе, они распадаются на свое ионное состояние.Катионы и анионы связаны с полярными молекулами воды. Напомним, что растворы, содержащие ионы, называются электролитами из-за их способности проводить электричество. Например, аммоний дихромат (NH 4 ) 2 CR 7 O 7 O 7 — это ионное соединение, которое содержит два NH 4 + ионы и один CR 2 O 7 2- иона на формульную единицу. Как и другие ионные соединения, это сильный электролит, который диссоциирует в водном растворе с образованием гидратированных ионов NH 4 + и Cr 2 O 7 2− .Если мы рассмотрим это решение математически, мы увидим, что на каждую растворяющуюся молекулу дихромата аммония будет приходиться три образующихся иона (два иона NH 4 + и один Cr 2 O 7 ). 2- ион). Это также можно представить в более крупном молярном масштабе. При растворении 1 моля (NH 4 ) 2 Cr 2 O 7 образуется 3 моля ионов (1 моль Cr 2 O 7 3– анионов и моль катионов NH 4 + ) в растворе (рис. 7.11). Для обсуждения взаимосвязи между концентрацией раствора и результирующим числом ионов используется термин эквивалентов .
Как и другие ионные соединения, это сильный электролит, который диссоциирует в водном растворе с образованием гидратированных ионов NH 4 + и Cr 2 O 7 2− .Если мы рассмотрим это решение математически, мы увидим, что на каждую растворяющуюся молекулу дихромата аммония будет приходиться три образующихся иона (два иона NH 4 + и один Cr 2 O 7 ). 2- ион). Это также можно представить в более крупном молярном масштабе. При растворении 1 моля (NH 4 ) 2 Cr 2 O 7 образуется 3 моля ионов (1 моль Cr 2 O 7 3– анионов и моль катионов NH 4 + ) в растворе (рис. 7.11). Для обсуждения взаимосвязи между концентрацией раствора и результирующим числом ионов используется термин эквивалентов .
Один эквивалент определяется как количество ионного соединения, которое обеспечивает 1 моль электрического заряда (+ или -). Он рассчитывается путем деления молярности раствора на общий заряд, созданный в растворе.
Он рассчитывается путем деления молярности раствора на общий заряд, созданный в растворе.
Рис. 7.11 Растворение 1 моля ионного соединения. При растворении 1 моля формульных единиц дихромата аммония в воде образуется 1 моль анионов Cr 2 O 7 2− и 2 моля катионов NH 4 + . (Для ясности молекулы воды не показаны на молекулярном изображении раствора.)
Когда мы проводим химическую реакцию с использованием раствора соли, такой как дихромат аммония, нам необходимо знать концентрацию каждого иона, присутствующего в растворе. Если раствор содержит 1,43 М (NH 4 ) 2 Cr 2 O 7 , то концентрация Cr 2 O 7 2− 3 также должна быть43 М, потому что на формульную единицу приходится один ион Cr 2 O 7 2− . Однако на формульную единицу приходится два иона NH 4 + , поэтому концентрация ионов NH 4 + составляет 2 × 1,43 М = 2,86 М. Поскольку каждая формульная единица (NH 4 ) 2 CR 2 CR 7 O 7 O 7 Производится Три ионов при расслоении в воде (2NH 4 + + 1Cr 2 O 7 2- ), Всего Концентрация ионов в решение 3 × 1.43 M = 4,29 M. Эквивалентное значение (NH 4 ) 2 Cr 2 O 7 можно рассчитать, разделив 1,43 M на 4,29 M, что даст 0,333 эквивалента. Так, для (NH 4 ) 2 Cr 2 O 7 растворение 0,333 моля соединения даст 1 моль ионов в растворе.
Поскольку каждая формульная единица (NH 4 ) 2 CR 2 CR 7 O 7 O 7 Производится Три ионов при расслоении в воде (2NH 4 + + 1Cr 2 O 7 2- ), Всего Концентрация ионов в решение 3 × 1.43 M = 4,29 M. Эквивалентное значение (NH 4 ) 2 Cr 2 O 7 можно рассчитать, разделив 1,43 M на 4,29 M, что даст 0,333 эквивалента. Так, для (NH 4 ) 2 Cr 2 O 7 растворение 0,333 моля соединения даст 1 моль ионов в растворе.
Пример 1
Каковы концентрации всех ионных частиц, полученных из растворенных веществ в этих водных растворах?
- 0.21 М NaOH
- 3,7 М (СН 3 )СНОН
- 0,032 М In(№ 3 ) 3
Дано: молярность
Запрашиваемый: концентраций
Стратегия:
A Классифицируйте каждое соединение как сильный электролит или неэлектролит.
B Если соединение является неэлектролитом, его концентрация равна молярности раствора. Если соединение является сильным электролитом, определяют количество каждого иона, содержащегося в одной формульной единице.Найдите концентрацию каждого вида, умножив количество каждого иона на молярность раствора.
Решение:
1. 0,21 М NaOH
A Гидроксид натрия представляет собой ионное соединение, которое является сильным электролитом (и сильным основанием) в водном растворе:
B Поскольку каждая формульная единица NaOH производит один ион Na + и один ион OH — , концентрация каждого иона такая же, как концентрация NaOH: [Na + ] = 0.21 М и [ОН — ] = 0,21
2. 3,7 М (CH 3 )CHOH
A Формула (CH 3 ) 2 CHOH представляет собой 2-пропанол (изопропиловый спирт) и содержит группу –OH, поэтому это спирт. Напомним из раздела 4.1 «Водные растворы», что спирты представляют собой ковалентные соединения, которые растворяются в воде с образованием растворов нейтральных молекул. Таким образом, спирты являются неэлектролитами
Напомним из раздела 4.1 «Водные растворы», что спирты представляют собой ковалентные соединения, которые растворяются в воде с образованием растворов нейтральных молекул. Таким образом, спирты являются неэлектролитами
B Таким образом, единственным растворенным веществом в растворе является (CH 3 ) 2 молекул CHOH, поэтому [(CH 3 ) 2 CHOH] = 3.7 М
3. 0,032 М In(NO 3 ) 3
A Нитрат индия представляет собой ионное соединение, которое содержит ионы In 3+ и ионы NO 3 − , поэтому мы ожидаем, что в водном растворе он будет вести себя как сильный электролит
B Одна формульная единица In(NO 3 ) 3 дает один ион In 3+ и три иона NO 3 − , т.е. Решение содержит 0.032 M In 3+ и 3 × 0,032 M = 0,096 M NO 3 – , т. е.
е.
(наверх)
7.10 Окружающая среда: загрязнение свинцом
История использования свинца в США
В главе 5 вы познакомились с EPA и тем, как отслеживаются параметры качества воздуха для определения уровней загрязнения.Одним из шести основных параметров, контролируемых в соответствии с Законом о чистом воздухе, является свинец. Свинец встречается в земной коре в очень малых количествах, ~ 0,001%, и выглядит как серо-голубой металл, мягкий и плотный. Он широко использовался в Соединенных Штатах во многих различных продуктах, включая батареи и смеси металлов, в качестве припоя для труб и в гончарных изделиях, хрустальном стекле и других известных коммерческих продуктах. Использование свинца было особенно высоким в красках для наружных работ и в качестве добавки к бензину (рис. 7.12). Из-за растущих проблем со здоровьем использование свинца во многих продуктах было прекращено и прекращено. Однако загрязнение свинцом почвы, воды и воздуха по-прежнему представляет проблему и создает повышенный риск для здоровья населения.
Однако загрязнение свинцом почвы, воды и воздуха по-прежнему представляет проблему и создает повышенный риск для здоровья населения.
Рисунок 7.12 История использования свинца в красках и бензине на протяжении большей части 20-го века. На графике показано преобладание красок на основе свинца на начальном этапе, за которым последовал бум на транспорте, что привело к широкому использованию этилированного бензина.Снижение после середины 1970-х годов произошло из-за контроля, введенного EPA для отказа от этилированного бензина. Источник: Filippelli, et al (2005), используется с разрешения.
Национальные стандарты качества атмосферного воздуха (NAAQS) для свинца установлены на верхнем пределе 0,15 микрограммов на кубический метр общего количества взвешенных частиц в качестве среднего значения за 3 месяца. Как видно из рисунка 7.13, уровень содержания свинца в атмосфере был очень высоким до середины 1990-х годов, после чего мы наблюдаем резкое падение уровня содержания свинца в атмосфере. Этот всплеск уровня свинца в значительной степени связан с выбросами транспортных средств, когда свинец использовался в качестве добавки к бензину. В 1970 году, когда было полностью признано негативное воздействие свинца на здоровье, Агентство по охране окружающей среды начало программу сокращения использования свинца в бензине. Полный запрет на этилированный бензин, вступивший в силу в 1996 году.
Этот всплеск уровня свинца в значительной степени связан с выбросами транспортных средств, когда свинец использовался в качестве добавки к бензину. В 1970 году, когда было полностью признано негативное воздействие свинца на здоровье, Агентство по охране окружающей среды начало программу сокращения использования свинца в бензине. Полный запрет на этилированный бензин, вступивший в силу в 1996 году.
Рисунок 7.13 Уровни свинца в атмосфере с 1980 по 2014 год. (A) Как интерпретировать графики качества воздуха от EPA. синяя полоса показывает распределение уровней загрязнения воздуха между участками тренда, отображая средние 80 %.Белая линия представляет собой среднее значение среди всех трендовых сайтов. На девяноста процентах сайтов концентрации ниже верхней линии, а на десяти процентах сайтов концентрации ниже нижней линии. (B) Годовой максимальный средний уровень содержания свинца в атмосфере за 3 месяца, демонстрирующий снижение уровня загрязнения свинцом на 99% с 1980 по 2017 год. Источник: EPA
Источник: EPA
.
Компания General Motors идентифицировала использование тетраэтилсвинца (TEL) в качестве присадки к топливу, повышающей общее октановое число бензина.Это позволило существенно повысить компрессию двигателя, что привело к повышению производительности автомобиля и большей экономии топлива.
TEL получают реакцией хлорэтана с натрием – сплавом свинца
4 NaPb + 4 CH 3 CH 2 Cl → (CH 3 CH 2 ) 4 Pb + 4 NaCl + 3 Pb
Продукт извлекается перегонкой с водяным паром, в результате чего остается шлам из отходов свинца и хлорида натрия.Несмотря на десятилетия исследований, не было обнаружено никаких реакций, улучшающих этот довольно сложный процесс, в котором участвует металлический натрий и который превращает только 25% свинца в TEL. ТЭЛ представляет собой вязкую бесцветную жидкость. Поскольку TEL имеет нейтральный заряд и содержит внешние углеродные группы, он обладает высокой липофильностью (любящей жир) и растворим в бензине.
При сжигании этилированного бензина выделяется не только углекислый газ и вода, но и свинец
(CH 3 CH 2 ) 4 Pb + 13 O 2 → 8 CO 2 + 10 H 2 O + Pb
Полученный свинец также может окисляться во время горения с образованием оксида свинца (II)
2 Pb + O 2 → 2 PbO
Образование Pb и PbO в двигателе автомобиля приводит к быстрому чрезмерному накоплению и серьезному повреждению двигателя.Таким образом, в бензин также необходимо было добавить молекулы, поглощающие свинец, для реакции со свинцовыми продуктами, образующимися при сгорании. Обычно для этого процесса использовали 1,2-дибромэтан и 1,2-дихлорэтан. Эти агенты реагируют с побочными продуктами свинца и образуют летучие бромид свинца (II) и хлорид свинца (II), которые затем могут выбрасываться в атмосферу из двигателя.
Повышенный уровень свинца в атмосфере, вызванный использованием автомобиля, сильно коррелирует с повышенным уровнем свинца в крови населения.
7.14 Снижение среднего уровня содержания свинца в крови у детей в США и общего количества свинца, ежегодно используемого в бензине, за 1974-1992 годы (адаптировано из USEPA 1999).
Биологическое действие свинца
Как только свинец всасывается в организм, он не выводится из организма. Вместо этого он накапливается в минерализующихся тканях, таких как кости и зубы, или в мягких тканях, таких как печень, почки и мозг. Мозг очень чувствителен. Исследование свинца в Цинциннати показало, что воздействие свинца в детстве вызывает потерю серого вещества в мозге, особенно в лобных областях, участвующих в исполнительной функции и принятии решений (рис. 7.15).
Рисунок 7.15 Воздействие свинца в детстве уменьшает размер мозга. Мозг взрослых, подвергшихся воздействию свинца в детстве, показывает уменьшение объема, особенно в префронтальной коре на МРТ. Области потери объема показаны цветом на шаблоне нормального мозга. Источник: Сесил, К.М. и др.
Источник: Сесил, К.М. и др.
Острое воздействие свинца может вызвать отравление свинцом и привести к болям в животе, запорам, головным болям, раздражительности, проблемам с памятью, неспособности иметь детей и покалываниям в руках и ногах.Это вызывает почти 10% умственной отсталости по неизвестной причине и может привести к поведенческим проблемам. Некоторые из эффектов являются постоянными. В тяжелых случаях возможны анемия, судороги, кома или смерть.
Воздействие свинца может происходить через загрязненный воздух, воду, пыль, продукты питания или потребительские товары Дети подвергаются большему риску, так как они чаще берут в рот предметы, содержащие свинцовую краску, и поглощают большую часть свинца. что они едят. Воздействие на работе является частой причиной отравления свинцом у взрослых людей, занимающихся определенными видами деятельности с особым риском.Диагноз обычно ставится путем измерения уровня свинца в крови. Центры по контролю за заболеваниями (США) установили верхний предел содержания свинца в крови для взрослых на уровне 10 мкг/дл (10 мкг/100 г) и для детей на уровне 5 мкг/дл.
Интересная взаимосвязь: преступность и уровень свинца в крови
Ряд исследований, проведенных за последнее десятилетие, показали сильную корреляцию между уровнем содержания свинца в крови дошкольников и последующим уровнем преступности, особенно насильственных преступлений, совершенных 20 лет спустя (рис. 7.16).
Рисунок 7.16 Корреляция уровня свинца в крови дошкольников и насильственных преступлений, совершенных 23 года спустя.
В начале 1990-х количество убийств и насильственных преступлений достигло рекордно высокого уровня, и конца этому не видно. Однако к концу 1990-х годов количество насильственных преступлений по стране сократилось на 40%. Было предложено множество гипотез этого быстрого снижения, в том числе увеличение числа заключенных и увеличение числа сотрудников полиции.Однако уровни свинца в крови демонстрируют очень сильную корреляцию с частотой насильственных преступлений с запаздыванием примерно в 20 лет. Кроме того, исследования на животных, включая хомяков и кошек, показали, что воздействие свинца усиливает или потенцирует агрессивное поведение. Кроме того, данные, собранные Риком Невином из других стран (Франция, Западная Германия, Италия и Австралия), которые имеют разные показатели содержания под стражей и полиции, показывают аналогичные тенденции в насильственных преступлениях с уровнями свинца в крови детей.Таким образом, есть убедительные доказательства того, что повышенное воздействие свинца в детстве в результате использования этилированного бензина объясняет, по крайней мере частично, рост уровня насильственных преступлений в 1980-х и начале 1990-х годов в Соединенных Штатах.
Кроме того, исследования на животных, включая хомяков и кошек, показали, что воздействие свинца усиливает или потенцирует агрессивное поведение. Кроме того, данные, собранные Риком Невином из других стран (Франция, Западная Германия, Италия и Австралия), которые имеют разные показатели содержания под стражей и полиции, показывают аналогичные тенденции в насильственных преступлениях с уровнями свинца в крови детей.Таким образом, есть убедительные доказательства того, что повышенное воздействие свинца в детстве в результате использования этилированного бензина объясняет, по крайней мере частично, рост уровня насильственных преступлений в 1980-х и начале 1990-х годов в Соединенных Штатах.
Текущие проблемы и опасения
Несмотря на то, что за последние 40-50 лет использование свинца резко сократилось, свинец все еще можно обнаружить в повышенных количествах в почве, особенно в городских и промышленных районах.Кроме того, ранее свинец использовался для строительства водопроводных труб, так как он прочен и податлив. Свинец больше не используется для строительства труб, но в более старых городах, таких как Флинт, все еще есть свинцовые трубы, а также медные и железные водопроводные трубы, в которых использовалась свинцовая пайка в стыках и соединениях труб. В апреле 2014 года это стало серьезной проблемой для жителей города Флинт, штат Мичиган. Город Флинт, штат Мичиган, столкнулся с серьезными финансовыми проблемами и, пытаясь сэкономить деньги, решил построить новый водопровод от озера Гурон для подачи питьевой воды в этот район.По оценкам, экономия затрат составит около 10 миллионов долларов в год. Однако строительство газопровода займет несколько лет. Таким образом, чтобы сразу сэкономить деньги, город Флинт решил временно переключить городскую воду на реку Флинт, пока заканчивался новый трубопровод. Тем не менее, речную воду труднее обрабатывать из-за больших колебаний количества остатков стока, и почти сразу же жители Флинта, штат Мичиган, начали жаловаться на неприятный запах и бесцветную воду, текущую из их кранов (рис.
Свинец больше не используется для строительства труб, но в более старых городах, таких как Флинт, все еще есть свинцовые трубы, а также медные и железные водопроводные трубы, в которых использовалась свинцовая пайка в стыках и соединениях труб. В апреле 2014 года это стало серьезной проблемой для жителей города Флинт, штат Мичиган. Город Флинт, штат Мичиган, столкнулся с серьезными финансовыми проблемами и, пытаясь сэкономить деньги, решил построить новый водопровод от озера Гурон для подачи питьевой воды в этот район.По оценкам, экономия затрат составит около 10 миллионов долларов в год. Однако строительство газопровода займет несколько лет. Таким образом, чтобы сразу сэкономить деньги, город Флинт решил временно переключить городскую воду на реку Флинт, пока заканчивался новый трубопровод. Тем не менее, речную воду труднее обрабатывать из-за больших колебаний количества остатков стока, и почти сразу же жители Флинта, штат Мичиган, начали жаловаться на неприятный запах и бесцветную воду, текущую из их кранов (рис. 7.17).
7.17).
Рисунок 7.17. ЛиЭнн Уолтерс демонстрирует образцы водопроводной воды на публичном собрании в январе 2015 года. Источник: Ladapo, J.A, et. др. (2017).
Анализ воды первоначально показал высокий уровень фекальных колиформных бактерий, что заставило Флинта, штат Мичиган, выпустить рекомендации по кипячению и увеличить количество хлора, используемого для обработки воды. Это, в свою очередь, увеличило производство тригалометанов. Тригалометаны образуются во время реакции дезинфицирующих средств на основе хлора в воде с присутствующими органическими материалами, такими как водоросли, присутствующие в реке Флинт.Тригалометаны связаны со многими проблемами со здоровьем, включая проблемы с печенью, почками и легкими, а также создают неприятный запах и вкус воды. Они также опасны при вдыхании, что делает душ в горячей загрязненной воде серьезным риском для здоровья.
Таким образом, пытаясь уменьшить образование побочных продуктов тригалометана, город Флинт начал добавлять в воду больше FeCl 3 , чтобы помочь удалить дополнительные органические материалы из этого источника воды. Однако им не удалось добавить какие-либо антикоррозионные молекулы, такие как ортофосфат. Многие водоочистные сооружения используют низкие концентрации ортофосфатов для взаимодействия со свинцом в трубах и образования нерастворимой футеровки из фосфата свинца, которая не просачивается в систему водоснабжения (рис. 7.18). Отсутствие контроля коррозии со стороны города Флинт в сочетании с повышенным содержанием FeCl 3 привело к резкому увеличению количества присутствующих ионов Cl – . Результатом было общее увеличение коррозионного потенциала, измеренного по массовому отношению хлорида к сульфату, от 0.45 для Детройтского водоснабжения до 1,60 для нового водоснабжения Флинт-Ривер. При таком коррозионном потенциале молекулы кислорода в воде начали окисляться и выделять растворимые формы свинца в водную систему (рис. 7.18). В дополнение к окисленным побочным продуктам свинца также выделялись окисленные формы железа, вызывающие большее обесцвечивание воды.
Однако им не удалось добавить какие-либо антикоррозионные молекулы, такие как ортофосфат. Многие водоочистные сооружения используют низкие концентрации ортофосфатов для взаимодействия со свинцом в трубах и образования нерастворимой футеровки из фосфата свинца, которая не просачивается в систему водоснабжения (рис. 7.18). Отсутствие контроля коррозии со стороны города Флинт в сочетании с повышенным содержанием FeCl 3 привело к резкому увеличению количества присутствующих ионов Cl – . Результатом было общее увеличение коррозионного потенциала, измеренного по массовому отношению хлорида к сульфату, от 0.45 для Детройтского водоснабжения до 1,60 для нового водоснабжения Флинт-Ривер. При таком коррозионном потенциале молекулы кислорода в воде начали окисляться и выделять растворимые формы свинца в водную систему (рис. 7.18). В дополнение к окисленным побочным продуктам свинца также выделялись окисленные формы железа, вызывающие большее обесцвечивание воды.
Рис. 7.18 Процесс коррозии во Флинте, штат Мичиган, водный кризис.
7.18 Процесс коррозии во Флинте, штат Мичиган, водный кризис.
Чтобы посмотреть интерактивную анимацию этого химического процесса, посмотрите этот
Видео Scientific American – Коррозионная химия: как свинец попал в питьевую воду Флинта
Из-за общественного протеста и отказа города Флинт принимать меры в связи с плохим качеством воды Технологический институт Вирджинии начал программу тестирования воды и обнаружил чрезвычайно высокие уровни содержания свинца во многих домах во Флинте, штат Мичиган.CDC заявляет, что не существует безопасных уровней свинца, которые можно потреблять, а стандарты EPA ограничивают содержание свинца в питьевой воде до 15 частей на миллиард. Самая высокая проба, зарегистрированная Технологическим институтом Вирджинии, составила 13 000 частей на миллиард из пробы в доме ЛиЭнн Уолтерс (рис. 7.17). Город Флинт вернулся к использованию системы водоснабжения Детройта в октябре 2015 года. Однако риск воздействия свинца на детей в этом районе, превышающий допустимый уровень в крови CDC, за этот период удвоился (рис. 7.19). В настоящее время ведется несколько ожидающих рассмотрения судебных исков из-за халатности властей города Флинт и органов, регулирующих качество воды в регионе.
7.19). В настоящее время ведется несколько ожидающих рассмотрения судебных исков из-за халатности властей города Флинт и органов, регулирующих качество воды в регионе.
Рисунок 7.19. Сравнение уровней свинца в крови во Флинте, штат Мичиган, до и после перехода на источник воды реки Флинт. Верхняя диаграмма показывает, что качество воды в 1 из 6 домов во Флинте, штат Мичиган, после перехода на источник воды из реки Флинт превысило пределы безопасности EPA. На нижней панели показаны уровни содержания свинца в крови детей, регулярно проверяемых на содержание свинца в этом районе как до, так и после перехода на новый источник воды. Источник: Исследование Flint Water Study
.
Предлагаемое задание: Учителя могут загрузить задание на основе обсуждения на тему «Несправедливость в отношении окружающей среды и влияние загрязнения воды токсичными веществами» во Флинте, штат Мичиган,
.
Задание экологической справедливости Flint Water Crisis
7. 11 Резюме
11 Резюме
Чтобы убедиться, что вы понимаете материал этой главы, вам следует просмотреть значения выделенных жирным шрифтом терминов в следующем резюме и спросить себя, как они связаны с темами этой главы.
Раствор представляет собой гомогенную смесь. Основным компонентом является растворитель , а второстепенным компонентом является растворенное вещество . Решения могут иметь любую фазу; например, сплав представляет собой твердый раствор.Растворенные вещества бывают растворимыми или нерастворимыми , что означает, что они растворяются или не растворяются в определенном растворителе. Термины смешивающийся и несмешивающийся вместо растворимых и нерастворимых используются для жидких растворенных веществ и растворителей. Утверждение подобно растворению подобно является полезным руководством для предсказания того, растворится ли растворенное вещество в данном растворителе.
Растворение происходит путем сольватации , процесса, при котором частицы растворителя окружают отдельные частицы растворенного вещества, разделяя их и образуя раствор.Для водных растворов используется слово гидратация . Если растворенное вещество молекулярное, оно распадается на отдельные молекулы. Если растворенное вещество является ионным, отдельные ионы отделяются друг от друга, образуя раствор, проводящий электричество. Такие растворы называются электролитами . Если диссоциация ионов завершена, раствор представляет собой сильный электролит . Если диссоциация только частичная, раствор представляет собой слабый электролит . Растворы молекул не проводят электричество и называются неэлектролитами .
Количество растворенного вещества в растворе представлено концентрацией раствора. Максимальное количество растворенного вещества, которое растворяется в данном количестве растворителя, называется растворимостью растворенного вещества. Такие растворы насыщены . Растворы, количество которых меньше максимального, являются ненасыщенными . Большинство растворов ненасыщенные, и существуют различные способы определения их концентрации. Масса/массовые проценты , объемные/объемные проценты и массовые/объемные проценты указывают процентное содержание растворенного вещества в общем растворе. частей на миллион (ppm) и частей на миллиард (ppb) используются для описания очень малых концентраций растворенного вещества. Молярность , определяемая как количество молей растворенного вещества на литр раствора, является общепринятой единицей концентрации в химической лаборатории. Эквиваленты выражают концентрации в виде молей заряда ионов. Когда раствор разбавлен, мы используем тот факт, что количество растворенного вещества остается постоянным, чтобы иметь возможность определить объем или концентрацию конечного разбавленного раствора.
Такие растворы насыщены . Растворы, количество которых меньше максимального, являются ненасыщенными . Большинство растворов ненасыщенные, и существуют различные способы определения их концентрации. Масса/массовые проценты , объемные/объемные проценты и массовые/объемные проценты указывают процентное содержание растворенного вещества в общем растворе. частей на миллион (ppm) и частей на миллиард (ppb) используются для описания очень малых концентраций растворенного вещества. Молярность , определяемая как количество молей растворенного вещества на литр раствора, является общепринятой единицей концентрации в химической лаборатории. Эквиваленты выражают концентрации в виде молей заряда ионов. Когда раствор разбавлен, мы используем тот факт, что количество растворенного вещества остается постоянным, чтобы иметь возможность определить объем или концентрацию конечного разбавленного раствора. Растворы известной концентрации можно приготовить либо путем растворения известной массы растворенного вещества в растворителе и разбавления до желаемого конечного объема, либо путем разбавления соответствующего объема более концентрированного раствора ( исходного раствора ) до желаемого конечного объема.
Растворы известной концентрации можно приготовить либо путем растворения известной массы растворенного вещества в растворителе и разбавления до желаемого конечного объема, либо путем разбавления соответствующего объема более концентрированного раствора ( исходного раствора ) до желаемого конечного объема.
Ключ на вынос
- Концентрации растворов обычно выражаются в молярности и могут быть приготовлены путем растворения известной массы растворенного вещества в растворителе или разбавления исходного раствора.
Концептуальные проблемы
Какое из изображений лучше всего соответствует 1 М водному раствору каждого соединения? Обоснуйте свои ответы.
- НХ 3
- ВЧ
- CH 3 CH 2 CH 2 OH
Na 2 SO 4
Какое из представлений, показанных в задаче 1, лучше всего соответствует 1 М водному раствору каждого соединения? Обоснуйте свои ответы.

- CH 3 CO 2 H
- NaCl
- Нет 2 Ю
- Нет данных 3 Заказ на поставку 4
- ацетальдегид
Ожидаете ли вы, что 1,0 М раствор CaCl 2 будет лучшим проводником электричества, чем 1,0 М раствор NaCl? Почему или почему нет?
Альтернативным способом определения концентрации раствора является моляльность , сокращенно m .Моляльность определяется как количество молей растворенного вещества в 1 кг растворителя . Чем это отличается от молярности? Можно ли ожидать, что 1 М раствор сахарозы будет более или менее концентрированным, чем 1 м раствора сахарозы? Поясните свой ответ.
Каковы преимущества использования растворов для количественных расчетов?
Ответить
а) Nh4 является слабым основанием, а это означает, что некоторые молекулы будут принимать протон от молекул воды, вызывая их диссоциацию на ионы H+ и -OH.
 Ион H+ связывается с Nh4, образуя Nh5+. Таким образом, это будет больше всего похоже на стакан № 2. б) HF — слабая кислота, хотя F сильно электроотрицательна. Это связано с тем, что молекула HF может образовывать прочные водородные связи с молекулами воды и оставаться в ковалентной связи, которую труднее диссоциировать. Таким образом, стакан № 2 также является хорошим выбором для этой молекулы, так как только часть H-F будет диссоциировать на ионы h4O+ и F-. c) CH 3 CH 2 CH 2 OH представляет собой ковалентное соединение и не будет диссоциировать в какой-либо заметной степени, поэтому стакан № 3 является правильным выбором.d) Na 2 SO 4 является растворимым ионным соединением и будет полностью диссоциировать на ионы, наиболее похожие на химический стакан № 1.
Ион H+ связывается с Nh4, образуя Nh5+. Таким образом, это будет больше всего похоже на стакан № 2. б) HF — слабая кислота, хотя F сильно электроотрицательна. Это связано с тем, что молекула HF может образовывать прочные водородные связи с молекулами воды и оставаться в ковалентной связи, которую труднее диссоциировать. Таким образом, стакан № 2 также является хорошим выбором для этой молекулы, так как только часть H-F будет диссоциировать на ионы h4O+ и F-. c) CH 3 CH 2 CH 2 OH представляет собой ковалентное соединение и не будет диссоциировать в какой-либо заметной степени, поэтому стакан № 3 является правильным выбором.d) Na 2 SO 4 является растворимым ионным соединением и будет полностью диссоциировать на ионы, наиболее похожие на химический стакан № 1.Да, потому что когда CaCl 2 диссоциирует, он образует 3 иона (1 Ca 2+ и 2 иона Cl – ), тогда как NaCl диссоциирует только на 2 иона (Na + и Cl – ) для каждой молекулы.
 Таким образом, CaCl 2 будет генерировать больше ионов на моль, чем 1 моль NaCl, и будет лучшим проводником электричества.
Таким образом, CaCl 2 будет генерировать больше ионов на моль, чем 1 моль NaCl, и будет лучшим проводником электричества.Если количество вещества, необходимое для реакции, слишком мало для точного взвешивания, использование раствора вещества, в котором растворенное вещество диспергировано в гораздо большей массе растворителя, позволяет химикам измерить количество вещества точнее.
Числовые задачи
Рассчитайте количество граммов растворенного вещества в 1000 л каждого раствора.
- 0,2593 М NaBrO 3
- 1.592 М КНО 3
- 1,559 М уксусная кислота
- 0,943 М йодата калия
Рассчитайте количество граммов растворенного вещества в 1000 л каждого раствора.
- 0,1065 М BaI 2
- 1,135 М Na 2 SO 4
- 1,428 М НХ 4 Бр
- 0,889 М ацетат натрия
Если все растворы содержат одно и то же растворенное вещество, то в каком растворе масса растворенного вещества больше?
- 1.
 40 л 0,334 М раствора или 1,10 л 0,420 М раствора
40 л 0,334 М раствора или 1,10 л 0,420 М раствора - 25,0 мл 0,134 М раствора или 10,0 мл 0,295 М раствора
- 250 мл 0,489 М раствора или 150 мл 0,769 М раствора
- 1.
Заполните следующую таблицу для 500 мл раствора.
дигидрат йодистого водородаСоединение Масса (г) Кроты Концентрация (М) сульфат кальция 4,86 уксусная кислота 3.62 1,273 бромид бария 3,92 глюкоза 0,983 ацетат натрия 2,42 Какова концентрация каждого вида в следующих водных растворах?
- 0,489 моль NiSO 4 в 600 мл раствора
- 1.
 045 моль бромида магния в 500 мл раствора
045 моль бромида магния в 500 мл раствора - 0,146 моль глюкозы в 800 мл раствора
- 0,479 моль CeCl 3 в 700 мл раствора
Какова концентрация каждого вида в следующих водных растворах?
- 0,324 моль K 2 MoO 4 в 250 мл раствора
- 0,528 моль формиата калия в 300 мл раствора
- 0,477 моль KClO 3 в 900 мл раствора
- 0.378 моль йодида калия в 750 мл раствора
Какова молярная концентрация каждого раствора?
- 8,7 г бромида кальция в 250 мл раствора
- 9,8 г сульфата лития в 300 мл раствора
- 12,4 г сахарозы (C 12 H 22 O 11 ) в 750 мл раствора
- 14,2 г гексагидрата нитрата железа (III) в 300 мл раствора
Какова молярная концентрация каждого раствора?
- 12.8 г гидросульфата натрия в 400 мл раствора
- 7,5 г гидрофосфата калия в 250 мл раствора
- 11,4 г хлорида бария в 350 мл раствора
- 4,3 г винной кислоты (C 4 H 6 O 6 ) в 250 мл раствора
Укажите концентрацию каждого реагента в следующих уравнениях, предполагая, что 20,0 г каждого реагента и объем раствора 250 мл для каждого реагента.

- BaCl 2 (водн.) + Na 2 SO 4 (водн.) →
- Ca(OH) 2 (водн.) + H 3 PO 4 (водн.) →
- Al(NO 3 ) 3 (водн.) + H 2 SO 4 (водн.) →
- Pb(NO 3 ) 2 (водн.) + CuSO 4 (водн.) →
- Al(CH 3 CO 2 ) 3 (водн.) + NaOH (водн.) →
Для эксперимента требуется 200.0 мл 0,330 М раствора Na 2 CrO 4 . Для приготовления этого раствора использовали исходный раствор Na 2 CrO 4 , содержащий 20,0% растворенного вещества по массе с плотностью 1,19 г/см 3 . Опишите, как приготовить 200,0 мл 0,330 М раствора Na 2 CrO 4 , используя исходный раствор.
Гипохлорит кальция [Ca(OCl) 2 ] является эффективным дезинфицирующим средством для одежды и постельных принадлежностей.
 Если раствор имеет концентрацию Ca(OCl) 2 3.4 г на 100 мл раствора, какова молярность гипохлорита?
Если раствор имеет концентрацию Ca(OCl) 2 3.4 г на 100 мл раствора, какова молярность гипохлорита?Фенол (C 6 H 5 OH) часто используется в качестве антисептика в ополаскивателях для рта и леденцах от горла. Если жидкость для полоскания рта имеет концентрацию фенола 1,5 г на 100 мл раствора, какова молярность фенола?
Если таблетку, содержащую 100 мг кофеина (C 8 H 10 N 4 O 2 ), растворить в воде, чтобы получить 10,0 унций раствора, какова молярная концентрация кофеина в растворе?
На этикетке некоторых лекарств есть инструкции добавить 10.0 мл стерильной воды с указанием, что в каждом миллилитре полученного раствора будет содержаться 0,500 г лекарства. Если больному назначена доза 900,0 мг, сколько миллилитров раствора следует ввести?
ответы
а. 39,13 г б. 161,0 г в. 93,57 г d.
 201,8 г
201,8 га. 1,40 л 0,334 М раствора, б. 25,0 мл 0,134 М раствора, в. 150 мл 0,769 М раствора
а.0,815 М, б. 2,09 м, гр. 0,182 м, д. 0,684 М
а. 0,174 М, б. 0,297 М, с. 0,048 М, д. 0,135 М
а. BaCl 2 = 0,384 М, Na 2 SO 4 = 0,563 М, б. Ca(OH) 2 = 1,08 М, h4PO4 = 0,816 М, с. Al(NO 3 ) 3 = 0,376 M, H 2 SO 4 = 0,816 M, d. Pb(NO 3 ) 2 = 0,242 М, CuSO 4 = 0,501 М, э. Al(CH 3 CO 2 ) = 0.392 М, NaOH = 2,00 М
1,74 × 10 −3 М кофеин
(наверх)
7.12 Каталожные номера
- Чанг (Питер) Чи (2016) Неорганическая химия.
 Либретексты . Доступно по адресу: https://chem.libretexts.org/Core/Inorganic_Chemistry/Chemical_Reactions/Chemical_Reactions_1/Solutions
Либретексты . Доступно по адресу: https://chem.libretexts.org/Core/Inorganic_Chemistry/Chemical_Reactions/Chemical_Reactions_1/Solutions - Болл, Д.У., Хилл, Дж.В., и Скотт, Р.Дж. (2016) КАРТА: Основы общей, органической и биологической химии . Свободные тексты. Доступно по адресу: https://chem.libretexts.org/Textbook_Maps/Introductory_Chemistry_Textbook_Maps/Map%3A_The_Basics_of_GOB_Chemistry_(Ball_et_al.)
- Аверилл, Б.А., Элдридж, П. (2012) Основы химии . Свободные тексты. Доступно по адресу: https://2012books.lardbucket.org/books/principles-of-general-chemistry-v1.0/index.html
- Гидрат. (2017, 30 августа).В Википедии , Свободной энциклопедии . Получено 16:20, 26 сентября 2017 г., с https://en.wikipedia.org/w/index.php?title=Hydrate&oldid=798015169
- Лоуэр, С. (2010). Растворы 1: Растворы и их концентрации. В онлайн-учебнике «Виртуальный учебник Chem1». Доступно по адресу: http://www.chem1.com/acad/webtext/solut/solut-1.
 html
html - Мичиганская сеть по охране окружающей среды для детей (2013 г.) Гигиена окружающей среды для детей в Мичигане.Вики по гигиене окружающей среды. Получено 6 сентября 2018 г. по адресу: http://wiki.mnceh.org/index.php/Neurotoxicity:_Lead
- участников Википедии. (2018, 5 сентября). Отравление свинцом. В Википедии , Свободной энциклопедии . Получено 02:05, 7 сентября 2018 г., с https://en.wikipedia.org/w/index.php?title=Lead_poisoning&oldid=858177302
- Ладапо, Дж.А., Мохаммед, А.К., и Нвосу, В.К. (2017) Загрязнение свинцом во Флинте, штат Мичиган, США, и других городах. Международный журнал экологического и научного образования, 11(5):1341-1351.Открытый доступ. Доступно по адресу: www.jese.net/makale_indir/1899
.
.
.
.
.
Создание стандартного раствора из другого раствора: разбавление
(из полного курса стехиометрии OLI)
Когда вы работаете в лаборатории, скорее всего, вы начинаете с концентрированного маточного раствора.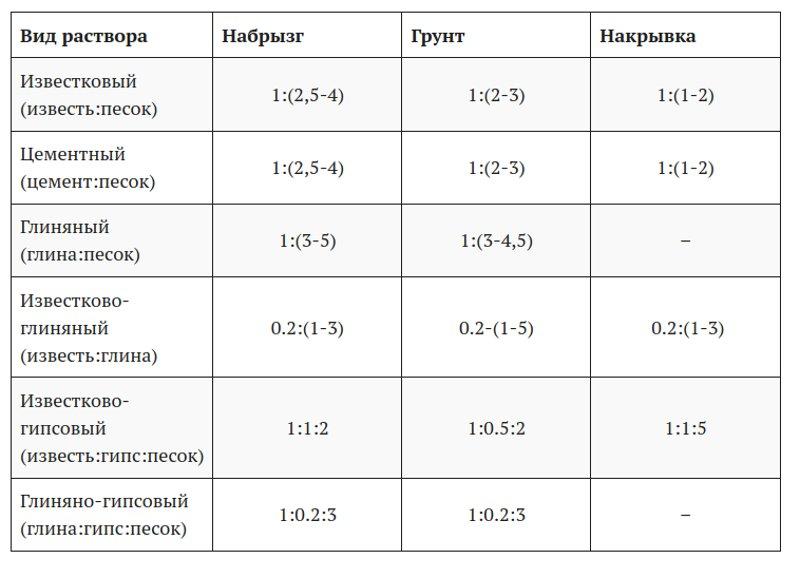 Быть способным
Быть способным
создавать растворы различной концентрации из этого полезного навыка. Растворы с известными концентрациями часто
так называемые «стандартные решения».» Вы можете узнать о концепции разбавления и о том, как использовать разбавление для создания стандарта
Решение со склада в следующем видео.
Разбавление текста фильма
Когда мы добавляем воду в раствор, мы понижаем концентрацию веществ, растворенных в этом растворе, за счет
процесс, называемый разбавлением. Мы можем воспользоваться разбавлением для приготовления растворов любой желаемой концентрации, когда
начинаем с более концентрированного раствора.Рассмотрим, например, химический склад, в котором находится раствор
1,00 М глюкозы. Допустим, мы хотим приготовить раствор с концентрацией глюкозы 0,50 М; т. е. мы хотим сократить
концентрация пополам. Мы можем сделать это, смешав равные объемы нашего 1,00 М раствора глюкозы с дистиллированной
вода. Например, если мы смешаем 1,0 л 1,0 М глюкозы с 1,0 л дистиллированной воды, мы удвоим объем.
Например, если мы смешаем 1,0 л 1,0 М глюкозы с 1,0 л дистиллированной воды, мы удвоим объем.
до 2,0 л и снизить концентрацию вдвое до 0,50 М.
Чтобы понять влияние разведения на концентрацию, мы отмечаем, что количество глюкозы не изменяется при
добавление воды в раствор.Добавление воды в раствор не создает и не разрушает молекулы глюкозы. Это означает
что количество молей глюкозы перед разбавлением равно количеству молей глюкозы
присутствует после разбавления.
Перед разбавлением у нас было 1,0 моль на литр * 1 литр, или 1,0 моль глюкозы. После разбавления 0,5
моль на литр * 2 литра, или, опять же, 1,0 моль глюкозы. Это частный случай более общего
выражение для разбавления, C 1 V 1 = C 2 V 2 .С 1 и
V 1 – концентрация и объем раствора до разбавления. Их продукт C 1
V 1 — количество молей глюкозы, присутствующей перед разбавлением. Точно так же C 2
V 2 — количество молей глюкозы, оставшейся после разбавления. С 1 В 1 =
C 2 V 2 отражает тот факт, что разбавление не изменяет количество молей глюкозы или другого растворенного вещества.
Скажем, я хочу получить 100 мл 0,29 М глюкозы, а моим исходным материалом является 1,0 М глюкоза. Как мне это сделать? я
начните с моего выражения C 1 V 1 = C 2 V 2 . Затем я рассматриваю то, что знаю
об этой ситуации. Я знаю, что моя начальная концентрация C 1 равна 1,0 М. Я также знаю, что желаемое
концентрация после разбавления C 2 равна 0,29 М. Я знаю, что хочу сделать 100 мл раствора, поэтому мой
объем после разбавления, V 2 , составляет 100 мл.Я могу решить это для V1, моего объема до разбавления и
получить 29 мл. Обратите внимание, что мне не нужно преобразовывать объем из мл в литры. Единицы молярности сокращаются, что дает
me V 1 в единицах мл.
Так как же мне выполнить это разведение в лаборатории? V 1 – объем раствора перед
разведения, поэтому я начинаю с приема 29 мл 1,0 М глюкозы. V 2 – объем после разбавления, т.е.
что после добавления воды объем должен быть 100 мл.Чтобы получить конечный объем 100 мл, я добавляю 100-29 или 71 мл.
воды. Добавление 71 мл воды даст мне 100 мл раствора с концентрацией 0,29 М.
Давайте сделаем это в виртуальной лаборатории. Я беру 29 мл 1,0 М глюкозы и добавляю 71 мл дистиллированной воды, и вы можете
увидеть, что я получаю 100 мл 0,29 М глюкозы.
Chem4Kids.com: Материя: Решения
Прежде чем мы углубимся в растворов , давайте отделим растворы от других типов смесей.Растворы — это группы молекул, которые смешаны и равномерно распределены в системе. Ученые говорят, что растворы — это однородных систем . Все в растворе равномерно распределяется и тщательно перемешивается. Гетерогенные смеси имеют немного больше одного элемента (более высокую концентрацию) в одной части системы по сравнению с другой.
Давайте сравним сахар в воде (H 2 O) с песком в воде. Сахар растворяется и распределяется по всему стакану воды.Песок опускается на дно. Сахар-вода представляет собой гомогенную смесь, в то время как песок-вода представляет собой гетерогенную смесь. Оба являются смесями, но раствором может быть названа только вода-сахар.
Довольно много. Растворы могут представлять собой твердые вещества , растворенные в жидкостях. Когда вы работаете с химией или даже готовите на кухне, вы обычно растворяете твердые вещества в жидкости. Растворы также могут представлять собой газы, растворенные в жидкостях, таких как газированная вода. Также могут быть газы в других газах и жидкости в жидкостях.Если вы перепутаете вещи, и они останутся в равномерном распределении, это решение. Вы, вероятно, не найдете людей, которые делают твердые-твердые решения. Обычно они начинаются как твердые/газообразные/жидкостно-жидкие растворы, а затем затвердевают при комнатной температуре. Сплавы со всеми типами металлов являются хорошими примерами твердых растворов при комнатной температуре.
Простое решение состоит в основном из двух веществ, которые равномерно смешаны вместе. Один из них называется растворенным веществом, а другой – растворителем. Растворенное вещество — это растворяемое вещество (сахар).Растворитель растворяет (вода). Как правило, растворителя обычно больше, чем растворенного вещества. Будьте терпеливы со следующим предложением, пока мы собираем все вместе. Количество растворенного вещества, которое может быть растворено растворителем, определяется как растворимость . Это много «сольных» слов.
В науке для всего есть особые имена. У них также есть названия для различных типов гомогенных смесей. Раствор — это общий термин, используемый для описания гомогенных смесей с мелкими частицами. Коллоиды представляют собой растворы с более крупными частицами. Коллоиды обычно туманные или молочные, когда вы смотрите на них. На самом деле молоко представляет собой эмульгированный коллоид .
Вы также можете услышать о коллоидах, если будете изучать почву. В то время как молоко представляет собой органических коллоидов, почвы могут состоять из неорганических коллоидов, таких как глина.
Подробнее о решениях в части II…
Круговорот воды в Водолее (видео НАСА/GSFC)
.

 Так как перепады температуры кладка трескается, что может стать причиной попадания дыма в помещение. Это является негативным фактором не только для интерьера, но и для здоровья.
Так как перепады температуры кладка трескается, что может стать причиной попадания дыма в помещение. Это является негативным фактором не только для интерьера, но и для здоровья. Прикрепите ее к кладке жидкой смесью.
Прикрепите ее к кладке жидкой смесью. При этом штукатурка с добавлением гипса практически не дает усадку. Гипс в некоторых случаях применяется в чистом виде.
При этом штукатурка с добавлением гипса практически не дает усадку. Гипс в некоторых случаях применяется в чистом виде.
 Однако, этот факт определяет его пластичность и прочность.
Однако, этот факт определяет его пластичность и прочность.



 Здесь все о листовых стеновых панелях для внутренней отделки.
Здесь все о листовых стеновых панелях для внутренней отделки.

 Для количественной обработки этого типа растворов мы посвятим единицу газам. Атмосфера представляет собой газообразный раствор, состоящий из азота, кислорода, аргона, углекислого газа, воды, метана и некоторых других второстепенных компонентов. Некоторые из этих компонентов, такие как вода, кислород и углекислый газ, могут различаться по концентрации в разных местах на Земле в зависимости от таких факторов, как температура и высота над уровнем моря.
Для количественной обработки этого типа растворов мы посвятим единицу газам. Атмосфера представляет собой газообразный раствор, состоящий из азота, кислорода, аргона, углекислого газа, воды, метана и некоторых других второстепенных компонентов. Некоторые из этих компонентов, такие как вода, кислород и углекислый газ, могут различаться по концентрации в разных местах на Земле в зависимости от таких факторов, как температура и высота над уровнем моря. Серебро, золото и медь образуют множество различных сплавов с уникальными цветами и внешним видом. Сплавы и другие твердые растворы играют важную роль в мире химии материалов.
Серебро, золото и медь образуют множество различных сплавов с уникальными цветами и внешним видом. Сплавы и другие твердые растворы играют важную роль в мире химии материалов.
 Ион H+ связывается с Nh4, образуя Nh5+. Таким образом, это будет больше всего похоже на стакан № 2. б) HF — слабая кислота, хотя F сильно электроотрицательна. Это связано с тем, что молекула HF может образовывать прочные водородные связи с молекулами воды и оставаться в ковалентной связи, которую труднее диссоциировать. Таким образом, стакан № 2 также является хорошим выбором для этой молекулы, так как только часть H-F будет диссоциировать на ионы h4O+ и F-. c) CH 3 CH 2 CH 2 OH представляет собой ковалентное соединение и не будет диссоциировать в какой-либо заметной степени, поэтому стакан № 3 является правильным выбором.d) Na 2 SO 4 является растворимым ионным соединением и будет полностью диссоциировать на ионы, наиболее похожие на химический стакан № 1.
Ион H+ связывается с Nh4, образуя Nh5+. Таким образом, это будет больше всего похоже на стакан № 2. б) HF — слабая кислота, хотя F сильно электроотрицательна. Это связано с тем, что молекула HF может образовывать прочные водородные связи с молекулами воды и оставаться в ковалентной связи, которую труднее диссоциировать. Таким образом, стакан № 2 также является хорошим выбором для этой молекулы, так как только часть H-F будет диссоциировать на ионы h4O+ и F-. c) CH 3 CH 2 CH 2 OH представляет собой ковалентное соединение и не будет диссоциировать в какой-либо заметной степени, поэтому стакан № 3 является правильным выбором.d) Na 2 SO 4 является растворимым ионным соединением и будет полностью диссоциировать на ионы, наиболее похожие на химический стакан № 1. 40 л 0,334 М раствора или 1,10 л 0,420 М раствора
40 л 0,334 М раствора или 1,10 л 0,420 М раствора 045 моль бромида магния в 500 мл раствора
045 моль бромида магния в 500 мл раствора
 Если раствор имеет концентрацию Ca(OCl) 2 3.4 г на 100 мл раствора, какова молярность гипохлорита?
Если раствор имеет концентрацию Ca(OCl) 2 3.4 г на 100 мл раствора, какова молярность гипохлорита? 201,8 г
201,8 г Либретексты . Доступно по адресу: https://chem.libretexts.org/Core/Inorganic_Chemistry/Chemical_Reactions/Chemical_Reactions_1/Solutions
Либретексты . Доступно по адресу: https://chem.libretexts.org/Core/Inorganic_Chemistry/Chemical_Reactions/Chemical_Reactions_1/Solutions html
html