Какой из растворов будет замерзать при более низкой температуре: ПРАВИЛЬНО? Какой из растворов будет замерзать при более низкой температуре?
- Температура замерзания концентрированных растворов — Справочник химика 21
- Замерзание растворов. Растворы замерзают при более низкой температуре чем чистый растворитель
- 5.5. Коллигативные свойства растворов — СтудИзба
- Общие сведения о температуре замерзания и кипения спиртов | Про самогон и другие напитки 🍹
- Персональный сайт — Билет №25
- Тема №8243 Ответы к задачам по химии 348 (Часть 2)
- Температура замерзания антифриза: почему нельзя заливать концентрат
- Депрессия точки замерзания
- Точка замерзания — MCAT Физический
- Замораживание и кипячение
- Точки замерзания и кипения
- Ответ по общей химии для Kimberli #156796
- Почему вода замерзает раньше спирта?
Температура замерзания концентрированных растворов — Справочник химика 21
Температура замерзания концентрированных растворов А12(804)з [c.756]
С. Смеси этиленгликоля с водой замерзают при значительно более низкой температуре. Самую низкую температуру замерзания (—75° С) имеет раствор, состоящий из 33% воды и 67% этиленгликоля. Эти свойства водных растворов этиленгликоля широко используются для изготовления низкозамерзающих жидкостей, применяемых в автомобильных и авиационных двигателях. Качество концентрированного этиленгликоля контролируется в основном по его физическим свойствам плотности, показателю преломления и по результатам разгонки в стандартном аппарате. [c.296]
Растворение белков в воде связано с гидратацией каждой молекулы, что приводит к образованию вокруг белковой глобулы водных (гидратных) оболочек, состоящих из ориентированных в определенной форме в пространстве молекул воды. По химическим и физическим свойствам вода, входящая в состав гидратной оболочки, отличается от чистого растворителя. В частности, температура замерзания ее составляет —40°С. В этой воде хуже растворяются сахара, соли и другие вещества. Растворы белков отличаются крайней неустойчивостью, и под действием разнообразных факторов, нарушающих гидратацию, белки легко выпадают в осадок. Поэтому при добавлении к раствору белка любых водоотнимающих средств (спирт, ацетон, концентрированные растворы нейтральных солей щелочных металлов), а также под влиянием физических факторов (нагревание, облучение и др.) наблюдаются дегидратация молекул белка и их выпадение в осадок. [c.26]
По химическим и физическим свойствам вода, входящая в состав гидратной оболочки, отличается от чистого растворителя. В частности, температура замерзания ее составляет —40°С. В этой воде хуже растворяются сахара, соли и другие вещества. Растворы белков отличаются крайней неустойчивостью, и под действием разнообразных факторов, нарушающих гидратацию, белки легко выпадают в осадок. Поэтому при добавлении к раствору белка любых водоотнимающих средств (спирт, ацетон, концентрированные растворы нейтральных солей щелочных металлов), а также под влиянием физических факторов (нагревание, облучение и др.) наблюдаются дегидратация молекул белка и их выпадение в осадок. [c.26]
Самую низкую температуру замерзания имеют растворы удельного веса 1,290. Когда замерзают растворы более низкого удельного веса, чем этот, то из раствора выделяются кристаллы обыкновенного льда, при более высоких удельных весах выделяются кристаллы тетрагидрата кислоты. Так как самые низкие температуры замерзания имеют растворы кислоты, соответствующие электролиту автомобильных батарей при полном их заряде, то ясно, что даже при самых суровых условиях опасность замерзания электролита в них отсутствует. Если же батарея разряжена, она замерзнет примерно при— 10° С или даже при более высокой температуре. Электролит или кислота, из которой он приготовляется, должны обладать надлежащим удельным весом, если их приходится сохранять в суровых температурных условиях. Электролит удельного веса от 1,225 до 1,400 не замерзнет в обычных условиях, но кислота, близкая к концентрированной удельного веса 1,800, замерзнет при -Ь 5° С. Для концентрированной кислоты температура замерзания гораздо ниже при удельном весе 1,835 она равна — 34° С. [c.125]
Если же батарея разряжена, она замерзнет примерно при— 10° С или даже при более высокой температуре. Электролит или кислота, из которой он приготовляется, должны обладать надлежащим удельным весом, если их приходится сохранять в суровых температурных условиях. Электролит удельного веса от 1,225 до 1,400 не замерзнет в обычных условиях, но кислота, близкая к концентрированной удельного веса 1,800, замерзнет при -Ь 5° С. Для концентрированной кислоты температура замерзания гораздо ниже при удельном весе 1,835 она равна — 34° С. [c.125]
Формальный смысл криоскопической постоянной, как и эбулиоскопической постоянной, заключается в том, что они означают понижение температуры замерзания или повышение температуры кипения одномоляльного раствора. Однако для таких концентрированных растворов использование метода криоскопии недопустимо, поэтому постоянную К, как и Е, определяют экстраполяцией. [c.118]
ВОЙ ДЛЯ твердого тела О1 и О2 отвечают температурам замерзания П и Га. Второй раствор является более концентрированным, давление пара растворителя над ним ниже, чем над первым, и, соответственно, ниже его температура замерзания. Понижения температуры замерзания первого раствора АГз(1) = 7 о—Гь а второго АГз(2)=Г2—Го. Исследованиями многих разбавленных растворов нелетучих веществ было показано, что АГз пропорционально концентрации растворенного вещества, т. е. [c.68]
Второй раствор является более концентрированным, давление пара растворителя над ним ниже, чем над первым, и, соответственно, ниже его температура замерзания. Понижения температуры замерзания первого раствора АГз(1) = 7 о—Гь а второго АГз(2)=Г2—Го. Исследованиями многих разбавленных растворов нелетучих веществ было показано, что АГз пропорционально концентрации растворенного вещества, т. е. [c.68]
Вывод об агрегации ионных пар впервые был сделан Краусом с сотрудниками [480, 481] как раз из понижений температур замерзания концентрированных растворов TA в бензоле и диоксане. [c.286]
Приведенные формулы дают возможность вычислять температуры замерзания и кипения растворов неэлектролитов по их концентрациям, а также находить молекулярные веса растворенных веществ по температурам замерзания или кипения растворов. Для концентрированных растворов, как и в случае осмотического давления, расчеты являются приближенными. [c.129]
[c.129]
Последовательность выполнения работы. 1. Приготовить раствор спирта ROH в бензоле заданной концентрации. 2. Приготовить три раствора меньшей концентрации разбавлением концентрированного раствора. 3. Определить понижение температуры замерзания всех растворов. 4. Вычислить молекулярный вес растворенного вещества по уравнению (VH, 12). 5. Построить график зависимости молекулярного веса от концентрации. 6. Определить графической экстраполяцией до пересечения с осью ординат молекулярный вес данного спирта. [c.449]
При вымораживании растворенных солей пользуются тем, что при замерзании концентрированных растворов первые порции льда состоят из чистого растворителя с малыми включениями растворимых солей, которые при повышении температуры плавятся первыми. [c.202]
Когда температура замерзания растворителя определена, в пробирку вводят растворяемое вещество в виде заранее приготовленной взвешенной таблетки. Навески следует брать такими, чтобы получился не слишком концентрированный раствор (0,1—0,2 т). Если нет формы для приготовления таблеток, то можно вводить растворяемое вещество, отсыпая его из взвешенной пробирочки после отсыпания вещества пробирочку снова взвешивают. Взвешивание производят на аналитических весах с точностью до 0,0002 г. [c.84]
Если нет формы для приготовления таблеток, то можно вводить растворяемое вещество, отсыпая его из взвешенной пробирочки после отсыпания вещества пробирочку снова взвешивают. Взвешивание производят на аналитических весах с точностью до 0,0002 г. [c.84]
Иначе обстоит дело с растворами. Присутствие растворенного вещества повышает температуру кипения и понижает температуру замерзания (или температуру плавления твердой фазы, что одно и то же) растворителя, и тем сильнее, чем концентрированнее раствор. В большинстве случаев из раствора кристаллизуется (при замерзании) или выкипает (при кипении) только растворитель, вследствие чего концентрация раствора в ходе его замерзания или кипения возрастает. Это, в свою очередь, приводит к еще большему повышению температуры кипения и снижению температуры кристаллизации. Таким образом, раствор кристаллизуется и кипит не при определенной температуре, а в некотором температурном интервале. Температуру начала кристаллизации и начала кипения данного раствора называют его температурой кристаллизации и температурой кипения. [c.229]
[c.229]
Наиболее низкую, температуру замерзания имеют растворы 55— 60%-ной концентрации. Концентрированная перекись водорода [c.651]
Применение получаемого хлорида кальция в народном хозяйстве основано на его высокой гигроскопичности, т. е. способности поглощать из воздуха значительные количества влаги и легко растворяться в воде пониженной по сравнению с водой температуре замерзания и повышенной температуре кипения концентрированных растворов (так, 30 %-ный раствор СаСЬ замерзает при температуре —55°С и кипит при температуре [c.192]
Формальный смысл криоскоиической постоянной, как и эбулиоскопической, заключается в том, что они означают понижение температуры замерзания или повышения температуры кипения одномоляльного, 1т, раствора. Однако для таких концентрированных растворов экспериментальное определение КиЕ недопустимо и их находят экстраполяцией [2, с. 114—115]. [c.153]
ХИТ, активируемые растворами кислот или щелочей. В этих ХИТ в качестве электролита используют концентрированные растворы кислот или щелочей, обладающие высокой электропроводимостью и низкой температурой замерзания. Активные вещества подбирают таким образом, чтобы в результате разряда, как правило, могли образоваться хорощо растворимые соединения. Поэтому такие ХИТ могут разряжаться высокими плотностями тока в широком интервале температур. [c.77]
В этих ХИТ в качестве электролита используют концентрированные растворы кислот или щелочей, обладающие высокой электропроводимостью и низкой температурой замерзания. Активные вещества подбирают таким образом, чтобы в результате разряда, как правило, могли образоваться хорощо растворимые соединения. Поэтому такие ХИТ могут разряжаться высокими плотностями тока в широком интервале температур. [c.77]
Величина 20/Тд всегда является малой по сравнению с единицей. Например, температура замерзания для воды понижается на 1,86 °С на каждый моль растворенного вещества в 1000 г растворителя, следовательно, величина 20/Г о невелика. Даже в очень концентрированных растворах эта величина не может быть больше 0,03. [c.43]
М г неэлектролита, растворенного в L г растворителя, давая более концентрированный раствор, понизит температуру замерзания его на [c.181]
Родан, образующийся из( солей путем электролиза. Родан образуется при электролизе концентрированных растворов роданистых солей щелочных металлов и аммония [20, 25, 28, 70]. Чаще всего применяют роданистый аммоний и для предотвращения разложения подвергаемого электролизу раствора поддерживают температуру ниже —8°. Устойчивость раствора обеспечивается, если концентрация родана не превышает концентрации, соответствующей комплексу НН (5СН)д. Амин или фенол растворяют в концентрированном растворе роданистой соли обычно к раствору прибавляют этиловый сиирт, чтобы понизить температуру замерзания смеси ниже —8 . Затем в раствор вводят катод из меди, алюминия, никеля или железа и вращающийся графитовый анод и ведут электролиз ири плотности тока [c.240]
Чаще всего применяют роданистый аммоний и для предотвращения разложения подвергаемого электролизу раствора поддерживают температуру ниже —8°. Устойчивость раствора обеспечивается, если концентрация родана не превышает концентрации, соответствующей комплексу НН (5СН)д. Амин или фенол растворяют в концентрированном растворе роданистой соли обычно к раствору прибавляют этиловый сиирт, чтобы понизить температуру замерзания смеси ниже —8 . Затем в раствор вводят катод из меди, алюминия, никеля или железа и вращающийся графитовый анод и ведут электролиз ири плотности тока [c.240]
Если вещество необходимо охладить до температуры ниже температуры замерзания воды, то обычно используют (если только не имеются в виду очень низкие температуры) смеси льда и различных электролитов. При соприкосновении этих веществ со льдом сначала возникают небольшие количества концентрированных водных растворов, которые замерзают при более низкой температуре, чем чистая вода.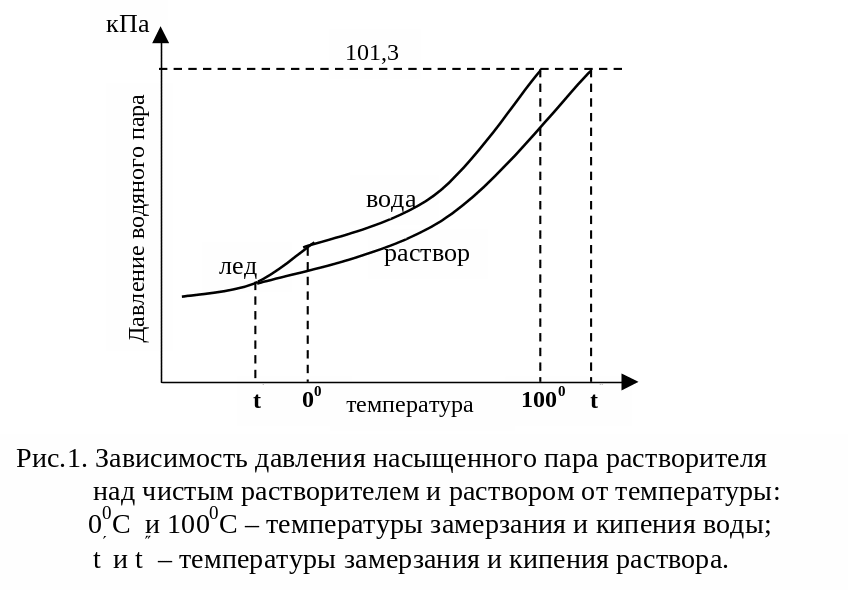 Это приводит к ускоренному таянию льда, что сопровождается быстрым поглощением тепла. Конечная температура смеси зависит от типа электролита и от количественного соотношения компонентов. Наиболее низкой достижимой температурой для данного электролита является температура плавления эвтектики. Как видно из табл. 9, этим способом можно приготовить охлаждающие бани [c.92]
Это приводит к ускоренному таянию льда, что сопровождается быстрым поглощением тепла. Конечная температура смеси зависит от типа электролита и от количественного соотношения компонентов. Наиболее низкой достижимой температурой для данного электролита является температура плавления эвтектики. Как видно из табл. 9, этим способом можно приготовить охлаждающие бани [c.92]
Способ увлажнения воздуха в камере влагой, испаряющейся из водных растворов солей, можно осуществлять при условии, когда концентрация рассола будет соответствовать температуре замерзания, близкой либо равной температуре воздуха в камере. Постоянное значение концентрации обеспечивается непрерывным добавлением в систему дробленого водного льда, инея либо воды. В противном случае при контакте воздуха с концентрированным раствором он будет осушаться. [c.181]
Концентрирование сточных вод можно осуществлять, используя процесс вымораживания, суть которого заключается в том, что при температуре ниже температуры замерзания чистая вода образует кристаллы пресного льда, и концентрированный рассол размещается между кристаллами льда.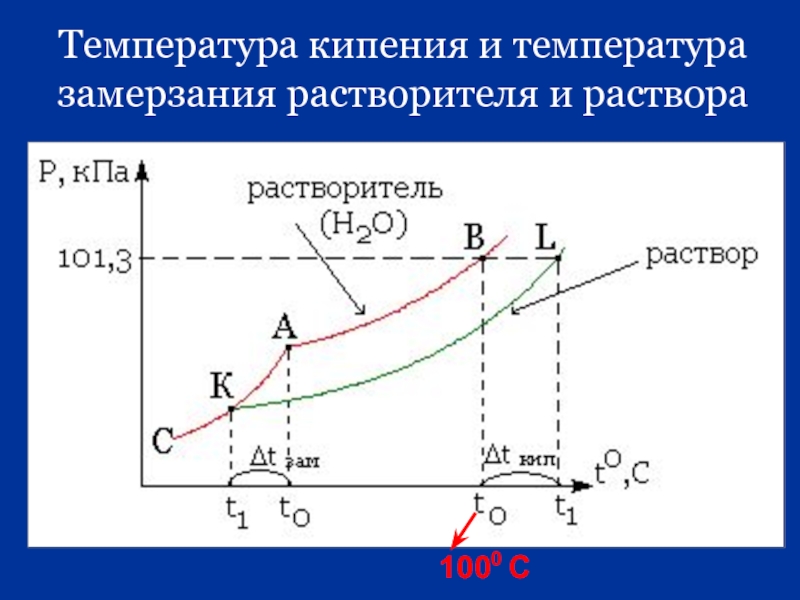 Для концентрирования растворов вымораживанием используют установки различной конструкции. Вымораживание проводят либо в вакууме, либо при помощи специального агента (хладагента). [c.235]
Для концентрирования растворов вымораживанием используют установки различной конструкции. Вымораживание проводят либо в вакууме, либо при помощи специального агента (хладагента). [c.235]
В жидких удобрениях водных — растворах солей — в случае большой нх концентрации происходит высаливание, кристаллизация солей при понижении температуры 2. Применение же менее концентрированных растворов приводит к необходимости перевозить большие количества растворителя — воды. Поэтому стремятся найти такие композиции жидких удобрений, которые имели бы высокие концентрации и низкие температуры кристаллизации (замерзания). Для хранения жидких удобрений требуется сооружение резервуаров большой емкости, так как они используются лишь в течение относительно короткого времени. [c.627]
После расплавления кристаллов раствор в охладительной смеси доводят до температуры на 0,1—0,15 °С выше приближенной температуры кристаллизации, пробирку с раствором помещают в воздушную рубашку, раствор переохлаждают на 0,2 °С и после перемешивания производят точный отсчет температуры кристаллизации раствора. Отсчет должен быть повторен несколько раз, так же как и в опыте с чистым растворителем. Затем вносят вторую порцию исследуемого вещества и определяют температуру замерзания второго, более концентрированного раствора. [c.130]
Отсчет должен быть повторен несколько раз, так же как и в опыте с чистым растворителем. Затем вносят вторую порцию исследуемого вещества и определяют температуру замерзания второго, более концентрированного раствора. [c.130]
Точка В, отвечающая составу 33,3% воды и 66,7% этиленгликоля и температуре замерзания —75 °С, близка к составу гидрата С2Н4(ОН)2 2НоО. При охлаждении раствора с содержанием воды больше 33,3% (кривая АВ) до температуры замерзания выпадают кристаллы льда в виде мягкой взвешенной шуги, а этиленгликоль остается в жидком состоянии. При охлаждении концентрированных растворов этиленгликоля (содержание воды менее 33,3%), при температуре замерзания выпадают кристаллы этиленгликоля, а вода остается в жидкод состоянии. В точке В одновременно кристаллизуются этиленгликоль и вода. [c.42]
При растворении пиросульфита натрия и калия в воде [27], а также в водных растворах нитрата натрия и хлорида аммония [28] при концентрации исходной соли менее 0,2 моль/л отмечается понижение температуры замерзания раствора по сравнению с чистым растворителем. Последнее согласно фактору Вант-Гоффа говорит о наличии в растворе Н и HSOJ hohob (1 1 электролита). В более концентрированных растворах (0,2-0,4 моль/л) величина фактора Вант-Гоффа меняется в пределах от 2,76 до 3,50 [82], т.е. близка к значению для электролитов 1 2, что свидетельствует о возможности распада соли пиросульфита при растворении на три иона. [c.40]
Последнее согласно фактору Вант-Гоффа говорит о наличии в растворе Н и HSOJ hohob (1 1 электролита). В более концентрированных растворах (0,2-0,4 моль/л) величина фактора Вант-Гоффа меняется в пределах от 2,76 до 3,50 [82], т.е. близка к значению для электролитов 1 2, что свидетельствует о возможности распада соли пиросульфита при растворении на три иона. [c.40]
В сравнимых условиях бензойная кислота дает понижение температуры замерзания, лишь вдвое превышающее предсказанное значение, что указывает на обычную кислотно-основную реакцию. Далее, при выливании в воду сернокислого раствора метил-мезитоата образуется мезитойная кислота, тогда как аналогичный раствор метилбензоата при этом не дает бензойной кислоты [436]. Механизм Аде встречается также и при гидролизе ацетатов фенолов или первичных спиртов в концентрированной (>90%) серной кислоте (при использовании разбавленной кислоты механизм обычный — Алс2) [437]. [c.113]
Однако переохлаждать раствор более чем на 1—1,5° не следует, так как количество выделяющейся из раствора твердой фазы растворителя ьу пропорционально переохлаждению и равно w — G At/ , где О — количество растворителя С — теплоемкость растворителя — переохлаждение. Чем больше переохлаждение, тем более концентрированному (за счет выделения твердой фазы растворителя) раствору соответствует измеренная температура замерзания. [c.354]
Чем больше переохлаждение, тем более концентрированному (за счет выделения твердой фазы растворителя) раствору соответствует измеренная температура замерзания. [c.354]
Смайс и Роджерс [1734] очищали бромоформ для измерений диэлектрической постоянной. Они промывали препарат концентрированной серной кислотой, разбавленным раствором едкого натра и водой. После осушки над безводным поташом вещество перегоняли при пониженном давлении. О чистоте препарата СУДИЛИ по ПОСТОЯНСТВУ плотности до третьего десятичного знака. Ковуд и Тернер [395] подвергали бромоформ дробной кристаллизации восемь раз. Температура замерзания составляла 7,5°. [c.408]
Хлорид кальция СаС12 очень хорошо растворим в воде и его концентрированные растворы могут служить теплоносителями (температура кипения до 443 К) или хладоагентами в холодильной технике (температура замерзания до 222 К). [c.302]
Стойкость концентрированной и чистой перскиси, получаемой в настоящее время почти исключительно путем дестилляции, настолько велика, что опасаться потери киоюрода не приходится, Вследствие низкой температуры замерзания 30%-ного раствора (при —25 ) даже в сильные морозы продукт можно пересылать в открытом виде. [c.278]
[c.278]
Очистка. В процессе исследования кинетики дегидрохлорирования замещенных хлоруглеводородов Бартон и Хоулет [183] разработали общий метод очистки хлоруглеводородов. Вещество многократно встряхивают с концентрированной серной кислотой до тех пор, пока добавление новых порций кислоты не перестанет приводить к появлению окраски. После этого хлорсодержащее вещество промывают сначала раствором бикарбоната натрия, а затем водой, сущат хлористым кальцием и перегоняют на эффективной колонке. В заключение вещество подвергают дробной кристаллизации до достижения постоянной в пределах Г температуры замерзания. При каждой кристаллизации вымораживают только половину жидкости, а остаток отбрасывают. [c.383]
Замерзание растворов. Растворы замерзают при более низкой температуре чем чистый растворитель
Растворы кипят при более высокой температуре чем чистый растворитель;
Следствия из закона Рауля
Растворы, которые строго подчиняются закону Рауля, являются идеальными. Для реальных растворов неэлектролитов закон Рауля соблюдается тем точнее, чем более разбавленным является этот раствор. По мере повышения концентрации растворенного вещества для большинства растворов наблюдаются отклонения от закона Рауля.
Для реальных растворов неэлектролитов закон Рауля соблюдается тем точнее, чем более разбавленным является этот раствор. По мере повышения концентрации растворенного вещества для большинства растворов наблюдаются отклонения от закона Рауля.
Относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества.
Не подчиняются закону Рауля растворы электролитов (кислот, оснований, солей). Причем, даже в тех случаях, когда они являются разбавленными. Причина этого явления будет нами рассмотрена позже.
Из закона Рауля вытекают два важных следствия:
Рассмотрим их более подробно.
Кипение является физическим процессом перехода жидкости в газообразное состояние или пар, при котором пузырьки газа образуются по всему объему жидкости.
Жидкость закипает, когда давление ее насыщенного пара становится равным внешнему давлению. Если внешнее давление (например, атмосферное) не изменяется, а сама жидкость является индивидуальным и химически чистым веществом, то кипение ее в открытом подогреваемом сосуде происходит при постоянной температуре до тех пор, пока полностью не исчезнет жидкая фаза.
Так при атмосферном давлении равном 101,325 кПа температура кипения очищенной (дистиллированной) воды равна 100 о С или 373,16 K.
Если же в Н 2 О растворить какое-нибудь нелетучее вещество, то давление ее насыщенного пара понизится. Чтобы получившийся раствор закипел, необходимо нагреть его до температуры выше, чем 373,16 K, т.к., только при таких условиях давление насыщенного пара растворителя снова станет равным атмосферному.
Замерзание или кристаллизация представляет собой физическое явление, сопровождающееся превращением жидкости в твердое вещество. Причем кристаллические структуры образуются во всем объеме жидкости.
Процесс замерзания начинается, если давление насыщенного пара над жидкостью становится равным давлению насыщенного пара над ее твердыми кристалликами.
Если внешнее (атмосферное) давление остается постоянным, а жидкость не содержит посторонних примесей, то в процессе кристаллизации температура охлаждаемой жидкости будет оставаться постоянной до тех пор, пока жидкая фаза полностью не превратится в твердую.
При атмосферном давлении равном 101,325 кПа дистиллированная вода замерзает при 0 о С (273,16 K). Давление насыщенного пара воды надо льдом и жидкостью в этом случае равно 613,3 Па.
Для водного раствора давление насыщенного пара растворителя при 0 о С будет меньше чем 613,3 Па, а надо льдом остается неизменным. Опущенный в такой раствор лед будет быстро таять, вследствие конденсации над ним избыточного количества пара.
Лишь при понижении температуры снова можно уравнять давление насыщенного пара над жидкой и твердой фазой и вызвать процесс кристаллизации.
Опытным путем было установлено, что повышение температуры кипения (Dt кип.) и понижение температуры замерзания раствора (Dt зам.) по сравнению с чистым растворителем прямо пропорционально моляльной концентрации растворенного вещества. Математически это можно записать следующим образом:
t кип. р-ра – t кип. р-теля = Dt кип. = Em
t зам. р-теля – t зам. р-ра = Dt зам. = Km
где m – моляльная концентрация растворенного вещества; E и K – соответственно, эбуллиоскопическая (лат. ebbulio – выкипаю) и криоскопическая (греч. «криос» — холод) константы, значения которых зависят только от природы растворителя (табл. 7).
ebbulio – выкипаю) и криоскопическая (греч. «криос» — холод) константы, значения которых зависят только от природы растворителя (табл. 7).
Таблица 7.
Эбуллиоскопические E и криоскопические K константы некоторых растворителей (град/моль)
Рис. 7.12. Понижение давления пара воды над раствором
Сплошные линии выражают границы фазовых полей для чистой воды. Напомним, что линия 1
отображает равновесие “жидкость — пар”. После добавления к воде нелетучего растворённого вещества давление пара над раствором (пунктирная линия 2
) понижается при любой температуре.
Любая жидкость будет замерзать (отвердевать) тогда, когда давление пара над ней сравнивается с давлением пара над твёрдой фазой (в случае воды — надо льдом). Поэтому и температура замерзания раствора Т зам
будет меньше, чем температура замерзания Т о зам
чистого растворителя — воды.
Ф.М.Рауль (1883) опытным путём установил, что понижение температуры замерзания (иначе — депрессия замерзания
)
DT зам
= Т о зам
— Т зам
,
вызываемое разными растворёнными веществами, взятыми в одинаковых молярных количествах, одинаково для данного растворителя. Так, для 0,1m водных растворов некоторых веществ наблюдаются следующие температуры затвердевания:
Так, для 0,1m водных растворов некоторых веществ наблюдаются следующие температуры затвердевания:
Вещество T зам
, o C
Пероксид водорода H 2 O 2 — 0,186
Метиловый спирт CH 3 OH — 0,181
Этиловый спирт C 2 H 5 OH — 0,183
Сахароза C 12 H 22 O 11 — 0,186
Декстроза C 6 H 12 O 6 — 0,188
При различных концентрациях растворённых веществ DT зам
пропорционально их моляльной концентрации m
:
DT зам
= К кр m
(7.1)
Коэффициент пропорциональности К кр
в уравнении (7.1), называемый криоскопической константой
, представляет собой молярное понижение температуры замерзания. Эта величина численно равна понижению температуры замерзания раствора, содержащего 1 моль растворённого вещества в 1 килограмме растворителя при условии, что раствор обладает свойствами идеального. Криоскопическая константа является характеристикой растворителя, её величина не зависит от природы растворённого вещества.
Моляльная концентрацияможет быть выражена через массы растворённого вещества (b)
и растворителя (а)
в граммах (см. п. 7.3):
где М
— молярная масса растворённого вещества (г/моль). Подставляя это выражение в уравнение (7.1), получим
Из этого уравнения следует одно очень важное обстоятельство, а именно: зная точный состав разбавленного раствора и измеряя температуры замерзания чистого растворителя и раствора, можно рассчитать молярную массу растворённого вещества:
Уравнение (7.2) лежит в основе криоскопического
(или криометрического
)метода
определения молярной массы веществ по понижению температуры замерзания их растворов.Криометрический метод находит широкое применение в лабораторной практике, в том числе и в фармации.
Принцип его заключается в следующем. Вначале измеряется температура плавления (или замерзания) точной навески а
выбранного растворителя. Затем к растворителю добавляется точная навеска исследуемого вещества b
и измеряется температура плавления полученной смеси (или температура замерзания, если вещество, выбранное в качестве растворителя, имеет низкую температуру плавления). Навеска растворённого вещества должна быть намного меньше, чем навеска растворителя, чтобы раствор получился разбавленным. Полученное значение DT зам
Навеска растворённого вещества должна быть намного меньше, чем навеска растворителя, чтобы раствор получился разбавленным. Полученное значение DT зам
подставляется в уравнение (7.2) и с его помощью вычисляется молярная масса исследуемого вещества. В простейшем случае в качестве растворителя может быть взята дистиллированная вода. Однако из-за малого значения криоскопической константы и низкой температуры замерзания, требующей применения криостатов или специальных охлаждающих смесей, вода применяется лишь для приблизительной оценки молярной массы веществ. Как правило, в особенности при изучении сложных органических веществ с большой молярной массой, в качестве растворителей выбираются другие вещества. При этом особое значение имеет камфора с её большой криоскопической константой. Главным условием для криометрического определения является полная растворимость исследуемого вещества в выбранном растворителе. Ниже приведены криоскопические константы некоторых веществ (при нормальном атмосферном давлении):
Вещество Т пл о С Криоскопическая
константа К кр
Бензол 5,5 5,12
Уксусная кислота 16,8 3,90
Циклогексан 6,5 20
Камфора 178,5 39,7
Криоскопический метод используется и для определения чистоты веществ. Это основано на том, что присутствие даже небольшой примеси снижает температуру плавления образца исследуемого вещества. Поэтому в химии (а также и в фармации) одним из критериев чистоты вещества является достижение максимальной температуры плавления, не возрастающей более после дополнительных операций очистки.
Это основано на том, что присутствие даже небольшой примеси снижает температуру плавления образца исследуемого вещества. Поэтому в химии (а также и в фармации) одним из критериев чистоты вещества является достижение максимальной температуры плавления, не возрастающей более после дополнительных операций очистки.
Ещё одно важное применение криоскопического эффекта — приготовление охлаждающих смесей. При определённом соотношении воды (или снега) и некоторых неорганических солей можно получить низкие температуры, удерживающиеся в течение достаточно длительного времени. Например, смесь, состоящая из 100 г снега и 143 г CaCl 2 ·6Н 2 О, позволяет получить температуру -55 о С.
В районах с холодным климатом в воду, используемую в автомобильных радиаторах, для предотвращения её замерзания зимой добавляются антифризы — такие вещества как спирт, глицерин или этиленгликоль. Лёд, намёрзший на проезжей части дорог и на тротуарах, легко плавится, когда его посыпают поваренной солью или золой, что тоже основано на криоскопическом эффекте. Следует только помнить, что неумеренное применение в этих целях соли может вызвать засоление близлежащих водоёмов и почв на их берегах и, как следствие, экологические нарушения.
Следует только помнить, что неумеренное применение в этих целях соли может вызвать засоление близлежащих водоёмов и почв на их берегах и, как следствие, экологические нарушения.
Замерзание представляет собой фазовый переход, при котором происходит превращение жидкости в твердое вещество. Температурой замерзания 9кристаллизации) жидкости называют ту температуру, при которой давление насыщенного пара над жидкостью равно давлению насыщенного пара над выпадающими из нее кристаллами твердой фазы.
При этой температуре и соответствующем ей давлении насыщенного пара скорость кристаллизации равна скорости плавления и обе эти фазы могут сосуществовать в течение длительного времени.
Еще М.В. Ломоносов заметил, что разбавленный раствор замерзает при температуре более низкой, чем чистый растворитель. Так, морская вода замерзает не при 273 К, а при несколько более низкой температуре. Многочисленные эксперименты показали, что такое изменение температуры замерзания раствора можно рассматривать как общее правило.
Процессы замерзания и кипения были детально изучены Раулем и представлены в виде закона, который в последствии был назван вторым законом Рауля.
рассмотрим простейший вывод этого закона. На рис.2 показана диаграмма, выражающая зависимость давления насыщенног пара от температуры над чистым растворителем и над раствором.
Кривая 0А – зависимость давления насыщенного пара чистой воды от температуры.
Кривая ВС, ДЕ – зависимость давления насыщенного пара воды над растворами с различными концентрациями растворенного вещества
0Д – выражает температурную зависимость давления насыщенного пара воды над льдом.
Из рис.2 видно, что давление пара над раствором при 273 К ниже, чем над водой, но оно не равно давлению пара над льдом при той же температуре. Лишь при температуре ниже 273 К (Т’з) давление пара над раствором уменьшается настолько, что становится равным давлению пара над льдом. Этому соответствует точка В. При более высоких концентрациях раствора кривые, выражающие зависимость давления пара воды над раствором от температуры, располагаются ниже кривой ВС, но параллельно ей.
Введем следующий обозначения:
Р 0 А – давление пара над чистым растворителем при 273 К
Р А – давление пара над раствором при температуре его замерзания Т’ з
Из прямоугольного треугольника ВОК определяем
Из рисунка 2 видно, что , где — понижение температуры замерзания раствора.
Подставляя эти значения в выше записанное уравнение, получим
(3)
Из первого закона Рауля для сильно разбавленных растворов имеем
и (4)
где n А, n В, m А сохраняют ранее присвоенные обозначения (см. выше). Если через М 0 А обозначить молярную массу растворителя, то
При подстановке этого выражения в уравнение (4) получим
Умножим и разделим правую часть этого выражения на 1000, тогда
(5)
Объединим все постоянные величины в уравнении (5) в одну постоянную К (), получим следующее выражение
(6)
Выражение представляет собой моляльность раствора Св.
Подставив это выражение в уравнение (6), получим окончательное уравнение.
(7)
Это и есть математическое выражение второго закона Рауля: понижение температуры замерзания или повышение температуры кипения растворов прямо пропорционально его моляльной концентрации.
Коэффициент К в уравнении (7) носит название криоскопической постоянной, показывает молярное понижение температуры замерзания раствора, является индивидуальной характеристикой растворителя (К Н2О =1,86º) и имеет ту же размерность, что и Е (Кº·кг·моль -1)
Метод исследования, основанный на измерении понижения температуры замерзания растворов, называется криоскопическим. Он также, как и эбуллиоскопический позволяет вычислить молярную массу растворенного вещества
На рис.3 изображен прибор, предназначенный для измерения температуры замерзания растворов.
ОСМОС И ОСМОТИЧЕСКОЕ ДАВЛЕНИЕ
.
Весьма важным в биологическом отношении свойством растворов является осмос.
В природе часто растворы отделяются от растворителя мембранами, проницаемыми лишь дл я частиц растворителя. В этом случае растворенное вещество диффундировать в растворитель не может, и будет наблюдаться только переход растворителя в в раствор, т.е. растворитель будет перемещаться в обоих направлениях, но все же в раствор его будет переходить немного больше, чем в обратном направлении.
Механизм осмоса легко представить на основе изотермической перегонки. Пусть полупроницаемая мембрана, имеющая микропоры, разделяет растворитель и раствор с концентрацией С в (рис.4)
В пору, ограниченную с одной стороны растворителем, а с другой раствором, идет испарение. Вследствие повышения по закону Рауля упругости насыщенного пара со стороны растворителя из парообразной фазы концентрируется, переходя в раствор.
В результате осмоса увеличивается объем раствора, и его концентрация постепенно снижается; проникающий через мембрану в раствор растворитель увеличивает столб жидкости h и, следовательно, повышает гидростатическое давление (см. рис.5). Одновременно будет возрастать число молекул растворителя, перемещающихся через мембрану в обратном направлении, т.е. из раствора в растворитель. постепенно гидростатическое давление и разбавление раствора достигнут величин, при которых количество молекул растворителя, перемещающихся в обоих направлениях, уравняется и наступит осмотическое равновесие. Развившееся в результате осмоса избыточное гидростатичекое давление, измеряемое столбом раствора высотой h, при котором устанавливается осмотическое равновесие, называют осмотическим давлением.
рис.5). Одновременно будет возрастать число молекул растворителя, перемещающихся через мембрану в обратном направлении, т.е. из раствора в растворитель. постепенно гидростатическое давление и разбавление раствора достигнут величин, при которых количество молекул растворителя, перемещающихся в обоих направлениях, уравняется и наступит осмотическое равновесие. Развившееся в результате осмоса избыточное гидростатичекое давление, измеряемое столбом раствора высотой h, при котором устанавливается осмотическое равновесие, называют осмотическим давлением.
рис. 5
Полупроницаемыми для многих растворов являются мембраны из коллодия, целлофана, железистосинеродистой меди и др.
ЗАКОНЫ ОСМОТИЧЕСКОГО ДАВЛЕНИЯ
.
Изучение законов осмотического давления выявило их полную аналогию с газовыми законами. Для разбавленных растворов неэлектролитов их можно сформулировать так:
при постоянной температуре осмотическое давление прямо пропорционально молярной концентрации растворенного вещества (аналогия с законом Бойля-Мариотта):
при постоянной молярной концентрации осмотическое давление прямо пропорционально абсолютной температуре (аналогия с законом Гей-Люссака):
Из двух этих законов следует, что при одинаковых молярных концентрациях и температуре растворы разных неэлектролитов создают одинаковое осмотическое давление, т. е. эквимолярные растворы неэлектролитов изотоничны (аналогия с законом Авогадро).
е. эквимолярные растворы неэлектролитов изотоничны (аналогия с законом Авогадро).
Вант-Гоффом был предложен объединенный закон для осмотического давления в растворах (аналогично объединенного газовому закону Менделеева-Клайперона): Осмотическое давление разбавленных растворов неэлектролитов прямо пропорционально молярной концентрации, коэффициенту пропорциональности и абсолютной температуре:
так как с=n/V, где n – число молей неэлектролита, а V – объем раствора, то или
Разбавленные растворы неэлектролитов.
Коллигативные свойства расвторов
Давление насыщенного пара
Равновесие “индивидуальная жидкость-пар” описывается константой равновесия
K p =p о нас. пара /a о ж (1)
Отсюда, поскольку активность индивидуальной жидкости а о ж =1, то давление насыщенного пара равно
p о пара = K p (2)
и зависит только от температуры.
Поскольку активность растворителя равна произведению a о ж на его молярную долю N 1 или же на (1 — N 2), где N 2 – молярная доля растворённого вещества, то константа равновесия равна:
K p =p 1 о =(p 1 /a о ж N 1)=(p 1 /1-N 2) (3)
Отсюда получаем закон Рауля
(1886):
p 1 =p 1 о (1-N 2)=p 1 о N 1 (4)
(p 1 о -p 1)/p 1 о)=N 2 (5)
Давление насыщенного пара раствора равно его давлению над чистым растворителем, умноженному на мольную долю растворителя.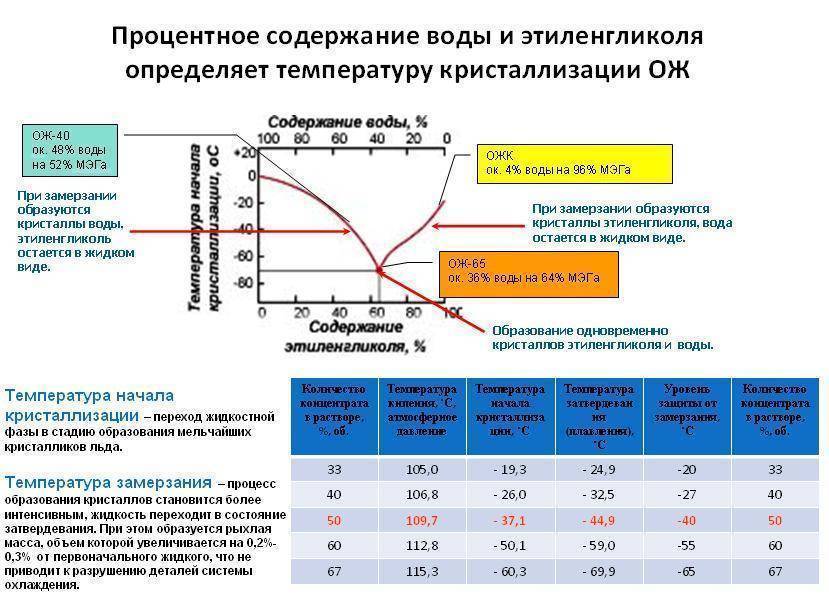
Относительное понижение давления насыщенного пара растворителя над чистым раствором равно мольной доле растворённого вещества.
Таким образом, давление пара уже зависит от содержания растворенного вещества. Закон Рауля можно использовать для определения молярной массы растворённого вещества:
Dp/p 1 ° =N 2 =n 2 /n 1 +n 2 ≈m 2 M 1 /m 1 M 2 (6)
Температура кипения растворов
Жидкость кипит, когда давление насыщенного пара становится равным внешнему давлению. Так как, по закону Рауля, давление пара над раствором меньше давления пара над чистым растворителем, то температура кипения раствора выше температуры кипения чистого растворителя.
Эксперименты показали, что для разбавленных растворов неэлектролитов:
где DТ — повышение температуры кипения раствора по сравнению с чистым растворителем, b — моляльность ([E]=К. Кг/моль) E- эбулиоскопическая постоянная (от ebbulio (лат.)- выкипать), зависящая только от свойств растворителя (его температуры кипения T о и удельная теплота испарения L 1):
E=RT о 2 /1000L 1 (8)
Температура кипения чистого растворителя имеет определённое значение при фиксированном внешнем давлении. Температура кипения раствора не постоянна — она растёт по мере кипения, так как за счёт испарения растворителя концентрация раствора увеличивается. При этом давление насыщенного пара всё время уменьшается. Поэтому температурой кипения раствора принято считать температуру, отвечающую появлению в нём первого пузырька пара.
Температура кипения раствора не постоянна — она растёт по мере кипения, так как за счёт испарения растворителя концентрация раствора увеличивается. При этом давление насыщенного пара всё время уменьшается. Поэтому температурой кипения раствора принято считать температуру, отвечающую появлению в нём первого пузырька пара.
Температура замерзания растворов
Над раствором давление пара растворителя ниже, чем давление пара над чистым растворителем. Давление пара над твёрдой и жидкой фазами тоже будет меньше. Это может быть только при более низкой температуре замерзания раствора по сравнению с чистым растворителем. Понижение температуры замерзания растворов неэлектролитов по отношению к температуре замерзания чистого растворителя пропорционально моляльности раствора:
где К- криоскопическая постоянная (от греч. “криос”- холод), зависящая только от свойств растворителя:
К=RT о 2 /1000L 1 , (10)
где T о, L * 1 — температура замерзания и удельная теплота плавления чистого растворителя.
Поскольку с затвердеванием растворителя возрастает концентрация растворённого вещества, то температура замерзания раствора непостоянна и уменьшается в ходе процесса. Поэтому за температуру замерзания раствора принимают температуру образования первого кристаллика.
В таблице 2 приведены значения Е и К для некоторых растворителей.
Таблица 2.
Кристаллы растворителя будут находиться в равновесии с раствором только тогда, когда давление насыщенного пара над кристаллами и над раствором одинаково. Поскольку давление пара растворителя над раствором всегда ниже, чем над чистым растворителем, температура, отвечающая этому условию, всегда будет более низкой, чем температура замерзания чистого растворителя. При этом понижение температуры замерзания раствора ΔT зам не зависит от природы растворенного вещества и определяется лишь соотношением числа частиц растворителя и растворенного вещества.
Можно показать, что понижение температуры замерзания раствора ΔT зам прямо пропорционально моляльной концентрации раствора:
Второй закон Рауля
: Повышение Ткип и понижение Тзам р-ра пропорциональны числу частиц растворенного вещества и не зависят от его природы.
Конец работы —
Эта тема принадлежит разделу:
Лекция № 5. Фазовые равновесия. Растворы неэлектролитов
Газообразное состояние вещества характеризуется слабым взаимодействием между частицами и большими расстояниями между ними Поэтому газы смешиваются… Общее давление газовой смеси равно сумме парциальных давлений всех входящих в…
Если Вам нужно дополнительный материал на эту тему, или Вы не нашли то, что искали, рекомендуем воспользоваться поиском по нашей базе работ:
Что будем делать с полученным материалом:
Если этот материал оказался полезным ля Вас, Вы можете сохранить его на свою страничку в социальных сетях:
Все темы данного раздела:
Лекция № 5. Фазовые равновесия. Растворы неэлектролитов.
Фазовые равновесия.
На прошлой лекции мы рассмотрели химическое равновесие, константу равновесия, ее связь с т.д. величинами и факторы, влияющие на сдвиг равновесия.
Двухкомпонентные системы.
Раствор – гомогенная система, состоящая из двух или более компонентов, состав которой может непрерывно изменяться в некоторых пределах без скачкообразного изменения её свойс
Образование раствора
Образование раствора является сложным физико-химическим процессом. Процесс растворения всегда сопровождается увеличением энтропии системы; при образовании растворов часто имеет место выделение либо
Процесс растворения всегда сопровождается увеличением энтропии системы; при образовании растворов часто имеет место выделение либо
Растворимость
Процесс растворения связан с диффузией, т. е. с самопроизвольным распределением частиц одного вещества между частицами другого. При внесении растворяемого вещества в растворитель процесс растворени
Растворимость газов в жидкостях
Растворимость газов в жидкостях зависит от ряда факторов: природы газа и жидкости, давления, температуры, концентрации растворенных в жидкости веществ (особенно сильно влияет на растворимость газов
Растворы неэлектролитов.
Свойства растворов рассматривают на примере разбавленных растворов, при образовании которых тепловой и объемный эффекты равны 0 (идеальные растворы). В таких растворах частица находятся на большом
Относительное понижение давления насыщенного пара над раствором равно мольной доле растворенного вещества.
Любая жидкость начинает кипеть при температуре, при которой давление ее насыщенного пара достигает величины внешнего давления. Т кип – Т, при которой давление пара= 101,3 кПа.Вода кипит при 100 С,
Т кип – Т, при которой давление пара= 101,3 кПа.Вода кипит при 100 С,
Осмотическое давление
Если разделить два раствора с различной концентрацией полупроницаемой перегородкой, пропускающей молекулы растворителя, но препятствующей переходу частиц растворённого вещества, будет наблюдаться я
5.5. Коллигативные свойства растворов — СтудИзба
5.5. Коллигативные свойства растворов.
Коллигативные свойства растворов — свойства раствора связанные друг с другом и обусловленные общими причинами, главным из которых является число растворенных частиц в растворе.
Добавление растворимого вещества к растворителю влияет на изменение физико-химических свойств не только растворенного вещества, но и самого растворителя. Изменение свойств растворенного вещества обусловлено образованием сольватов. Это выражается в изменении цвета, объема и т. п. Основной причиной изменения свойств растворителя является уменьшение концентрации его свободных молекул. В первую очередь изменяются такие свойства, как давление насыщенного пара растворителя, температуры замерзания и кипения раствора, а также осмотическое давление. Перечисленные свойства относятся к коллигативным свойствам растворов.
В первую очередь изменяются такие свойства, как давление насыщенного пара растворителя, температуры замерзания и кипения раствора, а также осмотическое давление. Перечисленные свойства относятся к коллигативным свойствам растворов.
I закон Рауля
Относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворимого вещества.
Математическим выражением закона Рауля является уравнение:
(Ро – Р)/Ро = N2,
где N2 – мольная доля растворенного вещества;
Рекомендуемые файлы
Р0 — давление насыщенного пара растворителя над чистым растворителем;
Р — давление насыщенного пара растворителя над раствором.
Давление насыщенного пара растворителя над раствором всегда ниже, чем, над чистым растворителем (Р0>P). Явление понижения давления насыщенного пара над раствором вытекает из принципа Ле Шателье. Представим себе равновесие между жидкостью, например, водой и ее паром. Это равновесие, которому отвечает определенное давление насыщенного пара, можно выразить уравнением
Это равновесие, которому отвечает определенное давление насыщенного пара, можно выразить уравнением
(Н2О)жидк ó (Н2О)пар
Если теперь растворить в воде некоторое количество какого-либо вещества, то концентрация молекул воды в воде понизится и пойдет процесс, увеличивающий ее, — конденсация пара. Новое равновесие установится при более низком давлении насыщенного пара.
Рассмотрим следствия, вытекающие из этого утверждения. На фазовой диаграмме однокомпонентной системы линия О*В* зависимости давления пара растворителя над раствором расположится ниже аналогичной кривой ОВ для чистого растворителя (рис. 5.2).
Отсюда вытекает первое следствие понижения давления насыщенного пара растворителя над раствором:
Раствор всегда кипит при температуре выше температуры кипения чистого растворителя.
Жидкость закипает тогда, когда давление насыщенного пара над ней становится равным внешнему давлению. Из рис.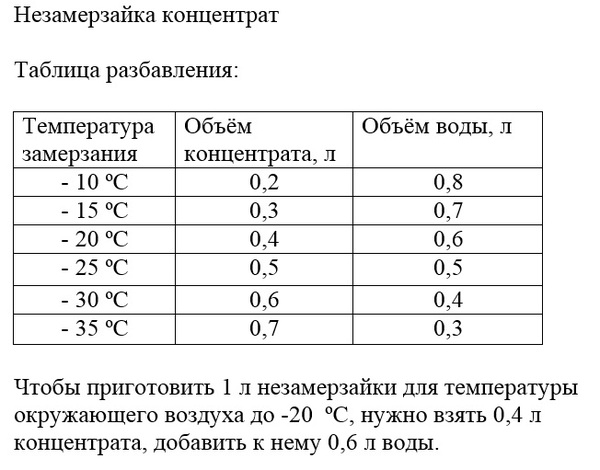 5.2 видно, что температура кипения раствора больше, чем температура кипения чистого растворителя, т. к. давление насыщенного пара растворителя достигает внешнего давления при более высокой температуре.
5.2 видно, что температура кипения раствора больше, чем температура кипения чистого растворителя, т. к. давление насыщенного пара растворителя достигает внешнего давления при более высокой температуре.
Рис. 5.2. Зависимость давления насыщенного пара растворителя над раствором и чистым растворителем.
Начало кристаллизации жидкости начинается, когда сравниваются давления насыщенных паров над твердой и жидкой фазой. На рис. 5.2. видно, что это происходит для раствора при более низкой температуре, чем для чистого растворителя. Следовательно:
Раствор начинает замерзать при более низкой температуре, чем чистый растворитель.
Этим свойством растворов широко пользуются дворники для очистки тротуаров ото льда зимой. Если ко льду добавить соль, то образуется раствор, температура замерзания которого ниже температуры окружающей среды, и лед тает.
Чем выше концентрация раствора, тем давление насыщенного пара растворителя над ним будет ниже, и раствор будет закипать при более высоких температурах, а замерзать при более низких. Отсюда:
Отсюда:
II закон Рауля
Повышение температуры кипения или понижение температуры кристаллизации раствора прямо пропорционально моляльной концентрации растворенного вещества.
∆tкип = КЭ·сm; ∆tкрист = КК·сm, (5.1)
где сm– моляльная концентрация раствора; КЭ – эбуллиоскопическая константа растворителя; КК – криоскопическая константа растворителя.
Моляльная концентрация в уравнениях, являющихся математическим выражением второго закона Рауля, применяется вследствие того, что во всех других способах выражения концентраций количество растворителя зависит от количества растворенного вещества, а в моляльной концентрации фиксировано количество растворителя (1000 граммов). Так что изменение температур плавления и кипения раствора будет зависеть лишь от количества частиц растворенного в нем вещества.
Физический смысл констант КЭ и КК легко сформулировать, допустив, что концентрация равна единице. Отсюда следует, что
Отсюда следует, что
эбуллиоскопическая постоянная равна моляльному повышению температуры кипения, а криоскопическая постоянная равна моляльному понижению температуры замерзания раствора.
Если в растворе растворено п граммов вещества в т граммах растворителя, то легко рассчитать моляльную концентрацию раствора. Для этого надо поделить массу растворенного вещества на М — его молекулярную массу, умножить на 1000 и разделить на массу растворителя. Получим, что
сm = 1000n/Mm.
Подставив полученное выражение концентрации в уравнения (5.1), получим уравнения для вычисления изменений температур плавления и кипения растворов:
∆tкип = КЭ· 1000n/Mm ; ∆tкрист = КК·1000n/Mm. (5.2)
Способность понижать температуру плавления или повышать температуру кипения растворов используют для определения молекулярных масс новых соединений.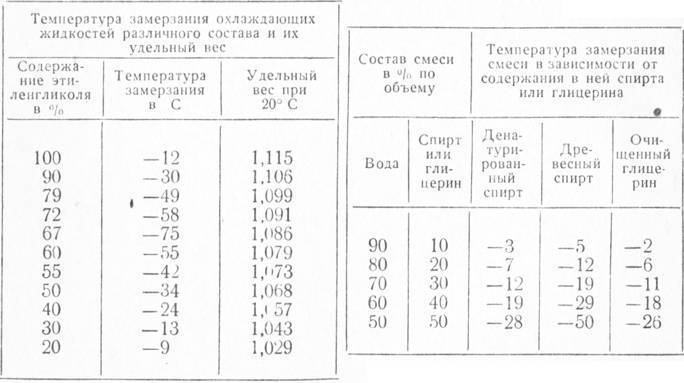 Массы неизвестного вещества и растворителя можно определить точно. Эбуллиоскопические и криоскопические постоянные определены с большой точностью для большого числа растворителей, и их значения можно найти в справочниках. Разность между температурами кипения чистого растворителя и раствора легко измеряется. Тогда в уравнениях (5.2) единственной неизвестной величиной является молекулярная масса, которую можно таким образом определить очень точно. Эти методы применимы только для соединений, не диссоциирующих в выбранном растворителе.
Массы неизвестного вещества и растворителя можно определить точно. Эбуллиоскопические и криоскопические постоянные определены с большой точностью для большого числа растворителей, и их значения можно найти в справочниках. Разность между температурами кипения чистого растворителя и раствора легко измеряется. Тогда в уравнениях (5.2) единственной неизвестной величиной является молекулярная масса, которую можно таким образом определить очень точно. Эти методы применимы только для соединений, не диссоциирующих в выбранном растворителе.
Методами эбуллиоскопии и криоскопии можно вычислять и среднюю степень полимеризации, так как с их помощью находят среднюю молекулярную массу полимера, а молекулярная масса мономера известна.
Осмос. Осмотическое давление.
Одним из свойств растворов, связанных с изменением количества свободных молекул растворителя, является осмос. Осмотические явления возникают на границе двух растворов различной концентрации, разделенных полупроницаемой перегородкой. Полупроницаемая перегородка пропускает только молекулы растворителя и препятствует проникновению через нее частиц растворенного вещества.
Полупроницаемая перегородка пропускает только молекулы растворителя и препятствует проникновению через нее частиц растворенного вещества.
Сущность явления осмоса состоит в том, что происходит выравнивание концентраций соприкасающихся растворов за счет самопроизвольного перехода молекул растворителя через полупроницаемую перегородку из одного раствора в другой под влиянием разницы их концентраций.
Возьмем сосуд, в котором два раствора разделены гибкой полупроницаемой перегородкой (рис. 5.3).
При равенстве концентраций растворов число молекул растворителя, проходящих из одного раствора в другой в единицу времени, будет одинаковым, вследствие чего объемы растворов не будут изменяться. Когда же концентрации растворов разные (см. рис. 5.3, Ci> C2), то скорость перехода молекул растворителя из менее концентрированного раствора выше,
Рис.5.3. Схема возникновения явления осмоса
чем из более концентрированного. Это приводит в данном случае к увеличению объема правого раствора и уменьшению левого. Осмос прекращается, когда концентрации в обоих растворах сравняются. Количественно это явление можно охарактеризовать величиной давления, которое нужно приложить к раствору, чтобы прекратилось проникновение молекул растворителя в раствор с большей концентрацией соли из более разбавленного. Такое давление называется осмотическим давлением.
Осмос прекращается, когда концентрации в обоих растворах сравняются. Количественно это явление можно охарактеризовать величиной давления, которое нужно приложить к раствору, чтобы прекратилось проникновение молекул растворителя в раствор с большей концентрацией соли из более разбавленного. Такое давление называется осмотическим давлением.
Рассчитать величину осмотического давления можно по формуле:
π=Cм RT, (5.3)
где π — осмотическое давление, См — молярная концентрация раствора (моль/л), R — универсальная газовая постоянная, Т — температура в К.
Если Вам понравилась эта лекция, то понравится и эта — Лейкоцитозы и лейкопении.
Если выразить концентрацию через количество вещества и объем в литрах: n/V и подставить это отношение в уравнение (5.3), получим выражение:
π V =n RT/V, (5.4)
напоминающее уравнение Менделеева-Клайперона для идеального газа.
Используя уравнение (5.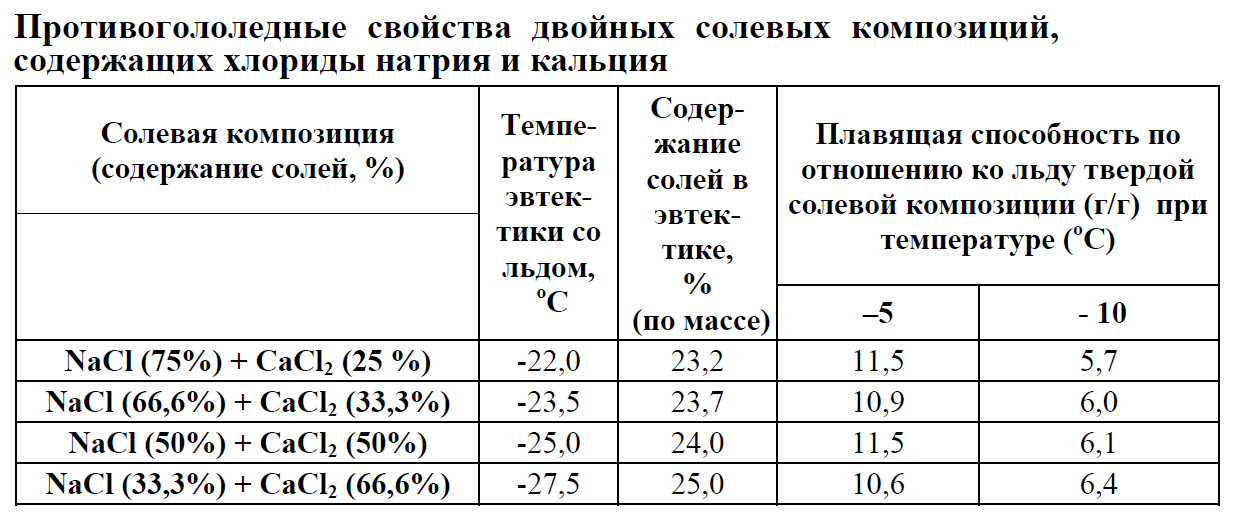 4), сформулируем физический смысл осмотического давления:
4), сформулируем физический смысл осмотического давления:
Осмотическое давление — это такое давление, которое создавало бы растворенное вещество в количестве n молей, если бы оно находилось в объеме раствора в газообразном состоянии при данной температуре.
Явление осмоса играет большую роль в биологии, так как свойствами полупроницаемых перегородок обладает большинство тканей организмов. Процессы обмена веществ, усвоение пищи тесно связаны с этим явлением. Резь в глазах, возникающая у человека при нырянии, также обуславливается различной проницаемостью молекул воды через глазные ткани. Этим же объясняется невозможность существования пресноводных рыб в морской воде.
Общие сведения о температуре замерзания и кипения спиртов | Про самогон и другие напитки 🍹
С понятием «спирт», «спиртовой раствор» мы сталкиваемся впервые в школьные годы, когда ставим опыты на уроках химии. Но с течением времени знания, полученные в период учебы, «испаряются» вследствие отсутствия возможности применения на практике.
Между тем кое-что из этих школьных знаний может пригодиться. Так температуру замерзания и кипения спирта полезно знать всякому, кто желает научиться отличать качественную водку от подделок, а также …автомобилистам. Поговорим об этом чуть подробнее.
Характеристики замерзания спирта
В большинстве случаев, говоря о спирте, мы имеем в виду этиловый – тот самый вид, который используется при производстве алкоголя. Его характеристиками являются температура замерзания и температура кипения. Так вот, если принять во внимание чистый этиловый спирт, то замерзнет он при очень низкой температуре: -110ºС.
Что значит «замерзнет»? Если перейти на языки химии, то это значит «перейдет из жидкого состояния в твердое». Температуру замерзания называют еще температурой плавления. Разумеется, добиться таких значений в бытовых условиях невозможно.
Почему же иногда, достав из морозилки давно забытую там бутылку водки, мы с удивлением обнаруживаем в ней куски льда?
Водно-спиртовой раствор
Дело в том, что водка не является чистым спиртом, а представляет собой раствор воды, в котором присутствует доля спирта. В зависимости от того, какова эта доля, меняется температура замерзания.
В зависимости от того, какова эта доля, меняется температура замерзания.
«Разброс» значений, при которых водка подвергается кристаллизации, от -27ºС до -34ºС. Это приблизительные показатели. Чем больше этанола в водке, тем ниже будет предел, когда она сможет превратиться из жидкого алкоголя в, так сказать, «алкогольное мороженое».
Интересно следующее: процесс замерзания идет постепенно, водка загустевает, превращаясь в подобие желе, и только после этого, если температура не меняется, становится твердой. И целиком она почти никогда не замерзает.
Причина: сначала меняют свои характеристики частички воды — они становятся маленькими льдинками. Концентрация спирта в бутылке становится выше, поэтому теперь раствору требуется более низкая температура, чтобы он стал льдом.
Вряд ли в холодильнике возможно создание условий, когда градус понизится до -33 или -40. Это в быту просто технически невозможно, даже если морозильная установка исправна.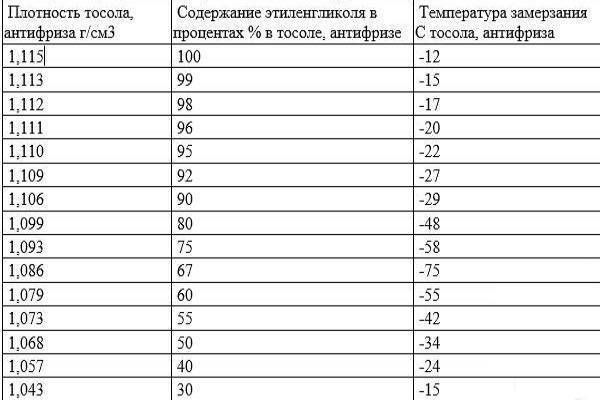 Поэтому полное превращение в лед вам вряд ли доведется наблюдать, а вот куски льда в бутылке – это вполне вероятно.
Поэтому полное превращение в лед вам вряд ли доведется наблюдать, а вот куски льда в бутылке – это вполне вероятно.
Таблица замерзания водно-спиртового раствора
Водно-спиртовой раствор будет менять свои характеристики в зависимости от того, какова доля этанола в нем.
Водно-спиртовой раствор будет менять свои характеристики в зависимости от того, какова доля этанола в нем.
Таким образом, если взять пиво (от легкого до довольно крепкого), то его можно поместить в морозилку и дождаться момента, когда оно полностью заморозится.
Вино обледенеет при температуре -7ºС, то есть тоже в обыкновенной морозилке.
А вот крепкий спиртной напиток заморозить с вероятностью 100% сложнее: все равно небольшое количество спирта останется жидким.
При скольки градусах замерзают прочие спирты?
Теперь возьмем для сравнения другие спирты. Сначала поговорим о самом «страшном» — метиловом. Он замерзнет, если температура внешней среды будет -97ºС. Для других спиртов верны следующие характеристики:
Он замерзнет, если температура внешней среды будет -97ºС. Для других спиртов верны следующие характеристики:
- температура замерзания пропилового -127ºС;
- амилового -78,5ºС;
- бутилового -80ºС.
Как используют способность этанола замерзать?
Вот мы и добрались до самого интересного – для чего замораживают спиртовые растворы? Все просто: для того, чтобы извлекать из них алкогольную составляющую в целях повышения крепости напитка.
А еще это свойство используют производители «незамерзайки», необходимой каждому автолюбителю в условиях нашей северной зимы. Некоторые владельцы автомобилей научились самостоятельно добавлять ей крепости в зависимости от погоды за окном.
Советуем почитать: Как происходит спиртовое брожение?
Кипение спирта
Добавим пару слов о температуре кипения. Спирт – не вода, при нагревании он гораздо быстрее начинает кипеть. При этом из него выделяются пары, вредные для здоровья человека. Вот почему важно знать, что этанол начинает закипать пи температуре +78ºС.
Спирт – не вода, при нагревании он гораздо быстрее начинает кипеть. При этом из него выделяются пары, вредные для здоровья человека. Вот почему важно знать, что этанол начинает закипать пи температуре +78ºС.
Водно-спиртовой раствор (в пропорциях 1 к 1) закипит при +85ºС.
Внимание: если давление растет, то температура кипения уменьшается. Цифры будут значительно отличаться от приведенных.
Вам есть что добавить к нашей статье? Мы готовы разместить ваши комментарии по теме – они будут полезны для всех. Пишите, будем делиться знаниями!
Персональный сайт — Билет №25
Повышение температуры кипения растворов
Жидкость кипит при той температуре, при которой общее давление насыщенного пара становится равным внешнему давлению. Если растворённое вещество нелетуче (то есть давлением его насыщенных паров над раствором можно пренебречь), то общее давление насыщенного пара над раствором равно парциальному давлению паров растворителя. В этом случае давление насыщенных паров над раствором при любой температуре будет меньше, чем над чистым растворителем, и равенство его внешнему давлению будет достигаться при более высокой температуре. Таким образом, температура кипения раствора нелетучего вещества Tb всегда выше, чем температура кипения чистого растворителя при том же давлении T°b.
В этом случае давление насыщенных паров над раствором при любой температуре будет меньше, чем над чистым растворителем, и равенство его внешнему давлению будет достигаться при более высокой температуре. Таким образом, температура кипения раствора нелетучего вещества Tb всегда выше, чем температура кипения чистого растворителя при том же давлении T°b.
- Повышение температуры кипения бесконечно разбавленных растворов нелетучих веществ не зависит от природы растворённого вещества и прямо пропорционально моляльной концентрации раствора
Понижение температуры кристаллизации растворов
Условием кристаллизации является равенство давления насыщенного пара растворителя над раствором давлению пара над твёрдым растворителем. Поскольку давление пара растворителя над раствором всегда ниже, чем над чистым растворителем, это равенство всегда будет достигаться при температуре более низкой, чем температура замерзания растворителя. Так, океанская вода начинает замерзать при температуре около минус 2 °C.
Так, океанская вода начинает замерзать при температуре около минус 2 °C.
Разность между температурой кристаллизации растворителя T°fr и температурой начала кристаллизации раствора Tfr есть понижение температуры кристаллизации.
- Понижение температуры кристаллизации бесконечно разбавленных растворов не зависит от природы растворённого вещества и прямо пропорционально моляльной концентрации раствора.
Поскольку по мере кристаллизации растворителя из раствора концентрация последнего возрастает, растворы не имеют определённой температуры замерзания и кристаллизуются в некотором интервале температур.
Антифриз (от греч. ἀντι- — против и англ. freeze — замерзать) — общее название для жидкостей, не замерзающих при низких температурах. Применяются в установках, работающих при низких температурах, для охлаждения двигателей внутреннего сгорания, в качестве жидкостей для омывания лобового стекла автомобилей, в качестве авиационных противообледенительных жидкостей.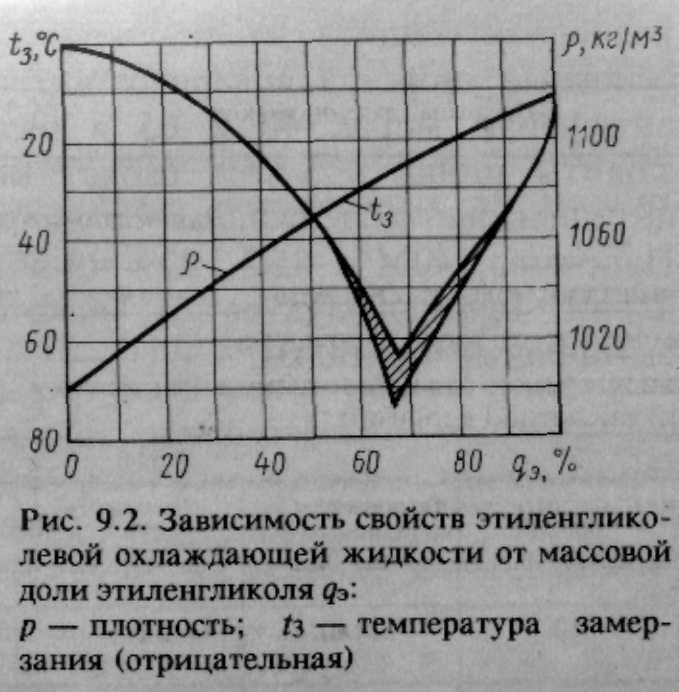 В качестве базовых жидкостей антифризов используются смеси этиленгликоля, пропиленгликоля, глицерина, спиртов и других веществ с водой.
В качестве базовых жидкостей антифризов используются смеси этиленгликоля, пропиленгликоля, глицерина, спиртов и других веществ с водой.
Тема №8243 Ответы к задачам по химии 348 (Часть 2)
Тема №8243
19 Давление пара водного раствора глюкозы С6Н12О6 при 750С равно
250 мм рт.ст. Вычислить процентную концентрацию раствора, если давление
пара воды при 75 °С равно 289,1 мм рт.ст. Ответ: 58,3%.
20 Давление пара чистого ацетона (СН3)2СO при 200С равно 179,6 мм
рт.ст. Вычислить давление пара раствора 2,5 г камфоры С10Н16О в 100 г
ацетона при той же температуре. Ответ: 177,9 мм рт.ст.
21 Давление пара раствора глицерина С3Н8О3 в воде при 400С равно
50мм рт.ст. Сколько приблизительно молекул воды приходится на одну
молекулу глицерина в указанном растворе? Давление пара воды при 400С
равно 55,32 мм рт.ст. Ответ: ~11.
22 Давление пара эфира (С2Н5)2 O при 300С равно 647,9 мм рт.ст.;
давление пара раствора 3,1 г анилина в 370 г эфира при той же температуре
равно 643,58 мм рт. ст. Вычислить молекулярную массу анилина. Ответ: 93.
ст. Вычислить молекулярную массу анилина. Ответ: 93.
23 Давление пара воды при 400С равно 55,32 мм рт.ст. Вычислить
понижение давления пара при растворении 0,2 моль вещества в 540 г воды.
Ответ: 334 мм рт.ст.
24 Давление пара эфира при 300С равно 648 мм рт.ст. Сколько молей
вещества надо растворить в 40 моль эфира, чтобы понизить давление пара
при данной температуре на 10 мм рт.ст.? Ответ: 0,627 моль.
25 Давление пара воды при 750С равно 289,1 мм рт. ст. В скольких
молях воды нужно растворить 0,4 моль вещества, чтобы при данной
температуре понизить давление пара на 9 мм рт.ст.? Ответ: 12,45 моль.
26 Давление пара воды при 550С равно 633,9 мм рт.ст. Вычислить
давление пара раствора, содержащего 29 г фенола С6Н5ОH в 900 г воды.
Ответ: 630,7 мм рт.ст.
27 Давление пара воды при 100 °С равно 760 мм рт.ст. Вычислить
давление пара над 4%-ным раствором мочевины СО(NН2)2 при этой
температуре. Ответ: 750,6 мм рт.ст.
28 При некоторой температуре давление пара над раствором,
содержащим 31 г анилина С6H5Nh3 в 30 моль эфира, равно 540,8 мм рт.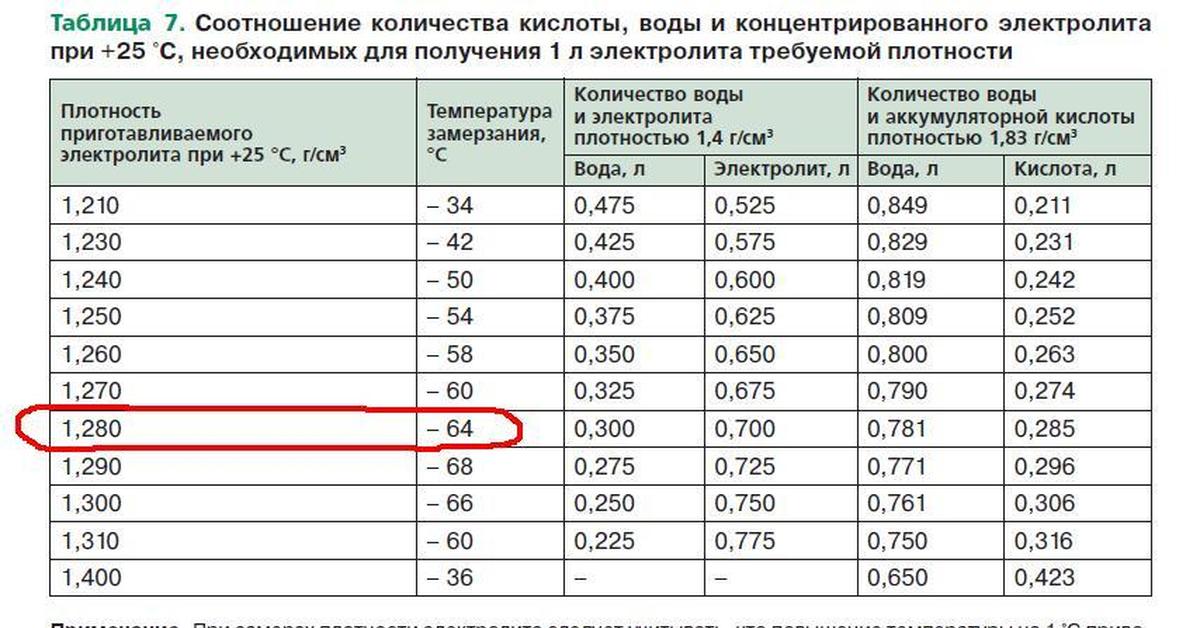 ст.
ст.
Вычислить давление пара эфира при этой температуре. Ответ: 546,8 мм
рт.ст.
29 Над раствором, содержащим 5,59 маннозы в 180 г воды, давление
пара при 800С равно 354 мм рт.ст., а давление пара воды при этой
температуре 355,1 мм рт.ст. Вычислить молекулярную массу маннозы.
Ответ: 180.
30 При некоторой температуре давление пара над раствором,
содержащим 2,44 г бензойной кислоты в 370,0 г эфира С4Н10О, равно 917,5
мм рт.ст. Давление пара эфира при этой температуре 921,2 мм рт.ст.
Вычислить молекулярную массу бензойной кислоты. Ответ: 122.
1 Вычислить повышение температуры кипения раствора, содержащего
0,488 г бензойной кислоты С7Н6О2 в 50,0 г хлороформа Ехлороформа=3, 88 град.
Ответ: 0,31 град.
2 Вычислить температуру кипения раствора, содержащего 0,5 моль
растворенного вещества в 1000 г ацетона. Eацетона=1,5 град; температура
кипения ацетона 56,0 град. Ответ: 56,75 град.
3 Вычислить температуру кипения раствора анилина в этиловом эфире,
содержащего 12 г анилина С6Н5Nh3 в 200 г раствора.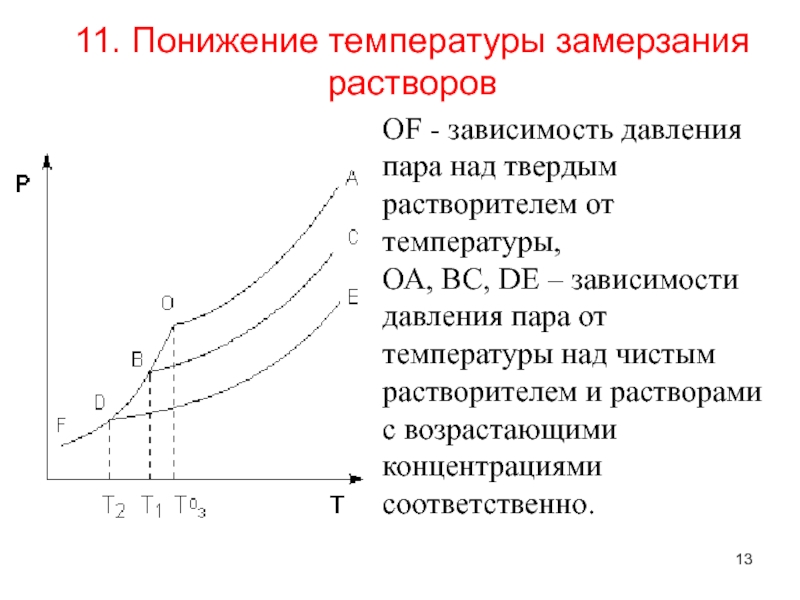 Еэфира=2,12 град;
Еэфира=2,12 град;
температура кипения эфира 35,6 град. Ответ: 370С.
4 В каком количестве сероуглерода нужно растворить 0,1 моль
вещества, чтобы раствор кипел при 470С? Температура кипения сероуглерода
46,30С; ЕCS2 =2,29 град. Ответ: 327 г.
5 Температура кипения эфира 35,60С, Еэфира=2,12 град. Вычислить
молекулярную массу бензойной кислоты, если 10%-ный раствор ее в эфире
кипит при 37,530С. Ответ: 122.
6 Раствор, содержащий 4,6 г глицерина С3Н5(ОН)3 в 200 г ацетона,
кипит при 56,730С. Чистый ацетон закипает при 56,30C. Вычислить
эбулиоскопическую константу ацетона. Ответ: 1,720
.
7 Сколько граммов глюкозы С6Н12О6 растворено в 500 г воды, если
раствор закипает при 100,2580С? Ответ: 45,35 г.
8 Сколько глицерина С3Н5(ОН)3 надо взять на 2 л воды, чтобы получить
раствор с температурой кипения 106 °С? Ответ: 2,156 кг.
9 5 г некоторого вещества растворено в 200 г воды. Температура
кипения раствора 100,4320С. Вычислить молекулярную массу растворенного
вещества. Ответ: 29,6.
Ответ: 29,6.
10 Температура кипения раствора 0,36 г фосфора в 60 г сероуглерода
(Е=2,4 град) на 0,120С выше, чем у чистого растворителя. Чему равна
молекулярная масса фосфора в растворе? Сколько атомов фосфора
заключается в одной молекуле? Ответ: Р4.
11 Температура кипения раствора 12,8 г серы в 250 г бензола
(Е=2,57град.) на 0,5140С выше, чем у чистого растворителя. Вывести
молекулярную формулу серы в растворенном состоянии. Сколько атомов
серы входит в состав одной молекулы этого вещества? Ответ: S8.
12 Определите температуру кипения 10%-ного водного раствора
глюкозы С6Н12O6. Ответ: 100,320C.
13 Определите температуру кипения раствора 1 г нафталина С10Н8 в
20г эфира, если температура кипения эфира равна 35,60С, а Е=2,160С.
Ответ:36,440С.
14 Раствор, состоящий из 9,2 г иода и 100 г метилового спирта,
закипает при 65,00С. Сколько атомов входит в состав молекулы иода,
находящегося в растворенном состоянии? Температура кипения спирта
64,70С, а E=0,840
. Ответ: I2.
Ответ: I2.
15 Вычислить температуру кипения раствора, содержащего 100 г
сахара С12Н22О11 в 750 г воды. Ответ: 100,20С.
16 Вычислить процентное содержание сахара С12Н22O11 в растворе,
температура кипения которого 100,130С. Ответ: 7,88%.
17 В каком количестве воды следует растворить 23 г глицерина С3Н8О3,
чтобы получить раствор с температурой кипения 100,1040С? Ответ:1250 г.
18 Какая часть моля сахара C12h32O11приходится на 1 моль воды в
растворе, температура кипения которого 100,0390С? Ответ: 1,35∙10-3 моль.
19 В скольких молях воды следует растворить 0,02 моля некоторого
неэлектролита для получения раствора с температурой кипения 100,0260С?
Ответ: 22,2 моль.
20 Температура кипения ацетона 56,10С, а Е=1,730
. Вычислить
температуру кипения 8%-ного раствора глицерина С3Н803 в ацетоне.
Ответ:57,730С.
21 Температура кипения эфира 34,50С, а Е=2,160
. Вычислить
молекулярную массу бензойной кислоты, если известно, что 5%-ный раствор
этой кислоты в эфире кипит при 35,530С. Ответ: 122.
Ответ: 122.
22 Температура кипения разбавленного раствора сахара C12h32O11
100,0650С. Вычислить осмотическое давление раствора при 00С. Плотность
раствора принять равной единице. Ответ: 271,5 кПа.
23 Раствор 55,4 г неэлектролита в 2,5 л воды кипит при 100,160С. Чему
равна молекулярная масса неэлектролита? Ответ: 72,0.
24 Повышение температуры кипения раствора 0,94 г фенола С6Н5ОН в
50 г этилового спирта (Е=1,16 град) 0,2320С. Найти молекулярную массу
фенола. Ответ: 94.
25 Раствор 15г хлороформа в 400г диэтилового эфира (Е=2,02 град)
кипит при температуре, превышающей температуру кипения растворителя на
0,635 °C. Вычислите молекулярную массу хлороформа. Ответ: 119,3.
26 При какой температуре должен кипеть раствор, содержащий
0,062моль неэлектролита в 200 мл воды? Ответ: 100,160С.
27 Раствор, содержащий 2,3 г С3Н8О3 в 100г ацетона (Ткип.=56,30С),
кипит при 56,730С. Найдите Е для ацетона. Ответ: 1,720С.
28 Сколько граммов сахара С12h32O11 надо растворить в 100 г воды,
чтобы а) повысить температуру кипения на 1 градус? б) Понизить
температуру замерзания на 1 град? Ответ: а) 65,8 г; б) 18,4 г.
29 При растворении 13 г неэлектролита в 400 г диэтилового эфира
(С2Н5)2O температура кипения повысилась на 0,453 градуса. Определить
молекулярную массу растворенного вещества. Ответ: 145.
30 Температура кипения водного раствора сахара C12h32O11 равна
101,40С. Вычислить моляльность раствора. При какой температуре замерзает
этот раствор? Ответ: 2 моль/кг; -3,720С.
31 Вычислить понижение температуры замерзания раствора,
содержащего 0,2 моль растворенного вещества в 750 г бензола (К=5,12 град).
Ответ: 1,365 град.
32 Температура замерзания уксусной кислоты 16,650С, а К=3,9 град.
Вычислить температуру замерзания раствора, содержащего 0,1 моль
растворенного вещества в 150 г уксусной кислоты. Ответ: 14,050С.
33 Вычислить температуру замерзания 10%-ного водного раствора
глюкозы С6Н12О6. Ответ: -1,0480С.
34 Температура замерзания бензола 5,50С. Криоскопическая константа
5,12 град. Сколько молей растворенного вещества содержится в 125 г
бензола, если раствор замерзает при 4,990С? Ответ: 0,012 моль.
35 Сколько глицерина С3Н8О3 нужно растворить в 200 г воды, чтобы
раствор замерзал при -1
0С? Ответ: 9,9 г.
36 Водный раствор сахара замерзает при -1,050С. Сколько процентов
сахара содержит этот раствор, если молекулярная масса сахара 342?
Ответ:16,2%
37 Раствор, содержащий 1,74 г растворенного вещества в 45,0 г воды,
замерзает при -1,20С. Вычислить молекулярную массу растворенного
вещества. Ответ: 60.
38 Антифризы – жидкости с пониженной температурой замерзания,
применяемые в системах охлаждения двигателей. Вычислить количество
этиленгликоля С2Н4(ОН)2 которое необходимо прибавить к 1 кг воды для
приготовления антифриза с температурой замерзания -150С. Ответ: 500 г.
39 При растворении 0,502 г ацетона (СН3)2 CO в 100 г уксусной
кислоты температура замерзания понижается на 0,3390C. Вычислить
криоскопическую константу уксусной кислоты. Ответ: 3,92 град.
40 Сколько граммов нафталина С10Н8 содержится в 3 кг бензола, если
раствор замерзает при 4,550С? Т.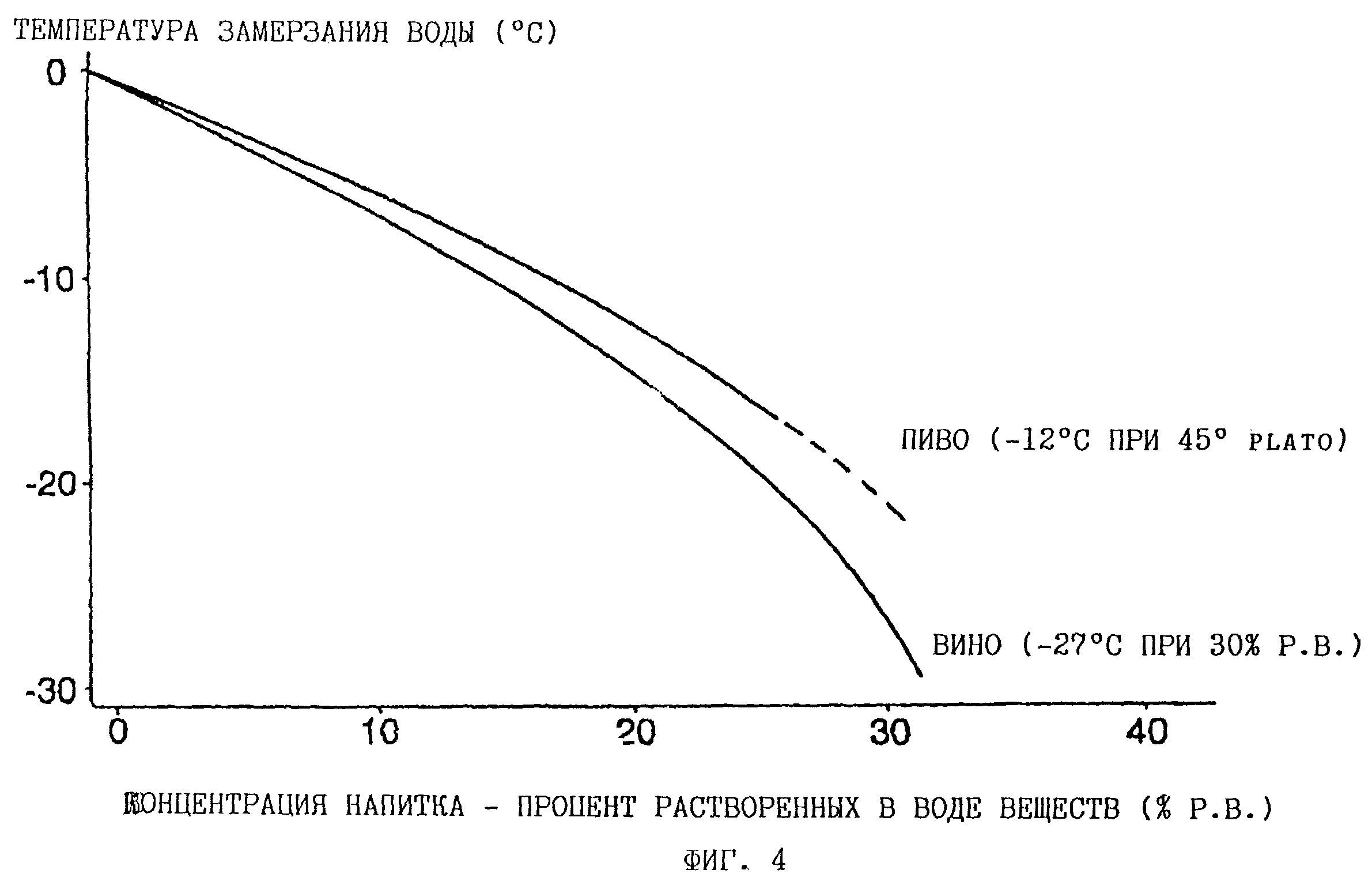 зам. бензола 5,50С, а К=5,1 град. Ответ:71,5г.
зам. бензола 5,50С, а К=5,1 град. Ответ:71,5г.
41 В 250 г воды растворено 1,6 г некоторого неэлектролита.
Температура замерзания раствора -0,20С. Вычислить молекулярную массу
неэлектролита. Ответ: 59,5.
42 Раствор, содержащий 6 г мочевины в 50 г воды, замерзает при
-3,720С. Вычислить молекулярную массу мочевины. Ответ: 60.
43 Для приготовления охлаждающей жидкости на 20 л воды взято 6 л
глицерина С3Н8О3. Чему равна температура замерзания приготовленной
смеси? Плотность глицерина равна 1,26 г/мл. Ответ: -7,560С.
44 Формалин, уксусная кислота и глюкоза имеют одинаковый
элементарный состав: С – 39,97%; Н – 6,73% и О – 53,30%. Приготовлены
три раствора: по 1,5 г каждого из перечисленных веществ на 25 г воды.
Температура замерзания растворов равны: первого – 3,72 °C, второго -1,860С
и третьего – 0,620С, Вывести молекулярные формулы указанных веществ.
Ответ: Формалин СН2O; уксусная кислота СН3СOOН; глюкоза С6Н12O6.
45 Раствор 1,05 г неэлектролита в 30 г воды замерзает при -0,70С.
Вычислите молекулярную массу неэлектролита. Ответ: 92,5.
46 Какова температура замерзания раствора неэлектролита,
содержащего 2,02∙1023 молекул в литре воды? Ответ: -0,620С.
47 Определите формулу вещества, содержащего 39,34% углерода,
8,20% водорода и 52,46% серы, если раствор 0,2 г этого вещества в 26 г
бензола замерзает при температуре на 0,3180С ниже, чем чистый бензол.
Oтвет: C4h20S2.
48 Понижение температуры замерзания раствора 0,052 г камфоры в 26г
бензола равно 0,0670C. Рассчитайте молекулярную массу камфоры.
Ответ:152,2.
49 Для приготовления охлаждающей жидкости на 30 л воды взято 9 л
глицерина С3Н8О3. Чему равна температура замерзания приготовленного
раствора? Плотность глицерина равна 1,261 г/мл. Ответ: 7,60С.
50 При какой температуре будет замерзать 25%-ный раствор этилового
спирта С2Н5ОН в воде? Ответ: -13,40С.
51 При какой температуре будет замерзать раствор, содержащий в 4 л
воды 500 г этиленгликоля С2Н4(ОН)2? Ответ: -3,730C.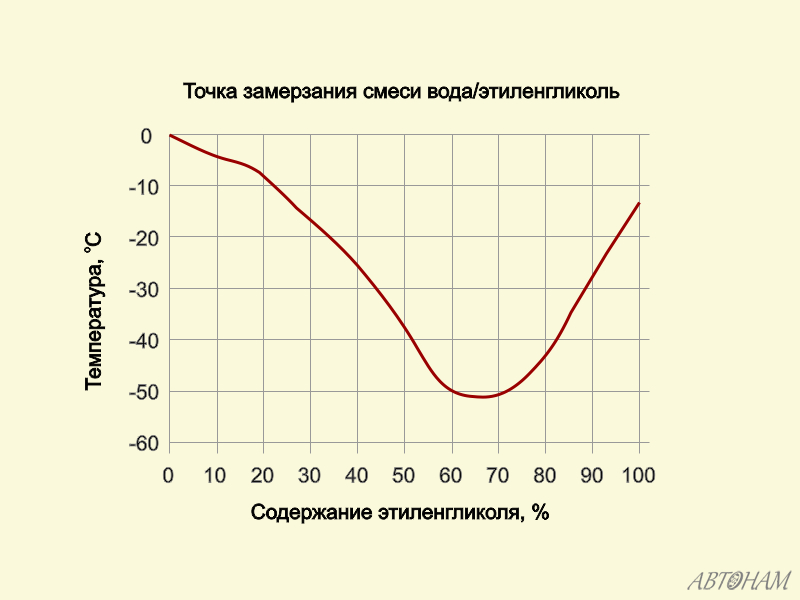
52 Сколько граммов нафталина С10Н8 находится в 8 кг бензола, если
этот раствор замерзает при 3,4 50С? Температура замерзания чистого бензола
5,400С. Ответ: 392 г.
53 Вычислить процентное содержание сахара С12Н22О11 в водном
растворе, температура замерзания которого -0,410С. Ответ: 7%.
54 Вычислить температуру замерзания водного раствора мочевины
СО(Nh3)2 , в котором на 100 молей воды приходится 1 моль растворенного
вещества. Ответ: -1,0330С.
55 Раствор сахара С12h32O11 оказывает при 270C осмотическое
давление, равное 156 кПа. Принимая плотность раствора равной единице,
вычислить температуру его замерзания. Ответ: -0,1190С.
56 В каком количестве воды следует растворить 0,5 кг глицерина
С3H8O3 для получения раствора с температурой замерзания – 3
0С?
Ответ:3,37кг.
57 При растворении 0,4 г некоторого вещества в 10 г воды температура
замерзания раствора понижается на 1,240C. Вычислить молекулярную массу
растворенного вещества.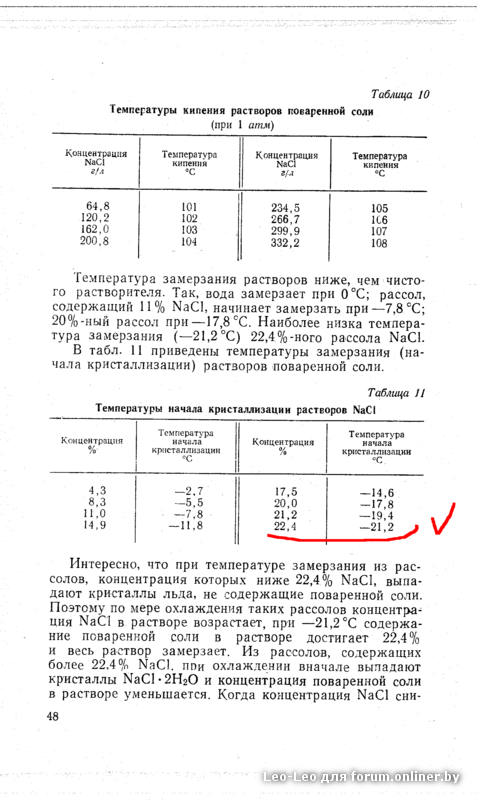 Ответ: 60.
Ответ: 60.
58 Водный раствор глицерина замерзает при температуре -2,790С.
Вычислить число молей глицерина, приходящихся на каждые 100 молей
воды, и давление пара раствора при 200С. Давление пара воды при 200С
равно 2,34 кПа. Ответ: 2,7 моля.
59 Раствор сахара в воде показывает повышение температуры кипения
на 0,312 °С. Вычислить величину понижения температуры замерзания этого
раствора. Ответ: 1,116 °С.
60 Давление пара водного раствора глицерина составляет 98% от
давления пара воды при той же температуре. Вычислить процентное
содержание глицерина в растворе и температуру кристаллизации раствора.
Ответ: 9,44%; -2,10С.
1 Вычислить повышение температуры кипения раствора, содержащего
0,488 г бензойной кислоты С7Н6О2 в 50,0 г хлороформа Ехлороформа=3, 88 град.
Ответ: 0,31 град.
2 Вычислить температуру кипения раствора, содержащего 0,5 моль
растворенного вещества в 1000 г ацетона. Eацетона=1,5 град; температура
кипения ацетона 56,0 град. Ответ: 56,75 град.
Ответ: 56,75 град.
3 Вычислить температуру кипения раствора анилина в этиловом эфире,
содержащего 12 г анилина С6Н5Nh3 в 200 г раствора. Еэфира=2,12 град;
температура кипения эфира 35,6 град. Ответ: 370С.
4 В каком количестве сероуглерода нужно растворить 0,1 моль
вещества, чтобы раствор кипел при 470С? Температура кипения сероуглерода
46,30С; ЕCS2 =2,29 град. Ответ: 327 г.
5 Температура кипения эфира 35,60С, Еэфира=2,12 град. Вычислить
молекулярную массу бензойной кислоты, если 10%-ный раствор ее в эфире
кипит при 37,530С. Ответ: 122.
6 Раствор, содержащий 4,6 г глицерина С3Н5(ОН)3 в 200 г ацетона,
кипит при 56,730С. Чистый ацетон закипает при 56,30C. Вычислить
эбулиоскопическую константу ацетона. Ответ: 1,720
.
7 Сколько граммов глюкозы С6Н12О6 растворено в 500 г воды, если
раствор закипает при 100,2580С? Ответ: 45,35 г.
8 Сколько глицерина С3Н5(ОН)3 надо взять на 2 л воды, чтобы получить
раствор с температурой кипения 106 °С? Ответ: 2,156 кг.
9 5 г некоторого вещества растворено в 200 г воды. Температура
кипения раствора 100,4320С. Вычислить молекулярную массу растворенного
вещества. Ответ: 29,6.
10 Температура кипения раствора 0,36 г фосфора в 60 г сероуглерода
(Е=2,4 град) на 0,120С выше, чем у чистого растворителя. Чему равна
молекулярная масса фосфора в растворе? Сколько атомов фосфора
заключается в одной молекуле? Ответ: Р4.
11 Температура кипения раствора 12,8 г серы в 250 г бензола
(Е=2,57град.) на 0,5140С выше, чем у чистого растворителя. Вывести
молекулярную формулу серы в растворенном состоянии. Сколько атомов
серы входит в состав одной молекулы этого вещества? Ответ: S8.
12 Определите температуру кипения 10%-ного водного раствора
глюкозы С6Н12O6. Ответ: 100,320C.
13 Определите температуру кипения раствора 1 г нафталина С10Н8 в
20г эфира, если температура кипения эфира равна 35,60С, а Е=2,160С.
Ответ:36,440С.
14 Раствор, состоящий из 9,2 г иода и 100 г метилового спирта,
закипает при 65,00С. Сколько атомов входит в состав молекулы иода,
Сколько атомов входит в состав молекулы иода,
находящегося в растворенном состоянии? Температура кипения спирта
64,70С, а E=0,840
. Ответ: I2.
15 Вычислить температуру кипения раствора, содержащего 100 г
сахара С12Н22О11 в 750 г воды. Ответ: 100,20С.
16 Вычислить процентное содержание сахара С12Н22O11 в растворе,
температура кипения которого 100,130С. Ответ: 7,88%.
17 В каком количестве воды следует растворить 23 г глицерина С3Н8О3,
чтобы получить раствор с температурой кипения 100,1040С? Ответ:1250 г.
18 Какая часть моля сахара C12h32O11приходится на 1 моль воды в
растворе, температура кипения которого 100,0390С? Ответ: 1,35∙10-3 моль.
19 В скольких молях воды следует растворить 0,02 моля некоторого
неэлектролита для получения раствора с температурой кипения 100,0260С?
Ответ: 22,2 моль.
20 Температура кипения ацетона 56,10С, а Е=1,730
. Вычислить
температуру кипения 8%-ного раствора глицерина С3Н803 в ацетоне.
Ответ:57,730С.
21 Температура кипения эфира 34,50С, а Е=2,160
. Вычислить
молекулярную массу бензойной кислоты, если известно, что 5%-ный раствор
этой кислоты в эфире кипит при 35,530С. Ответ: 122.
22 Температура кипения разбавленного раствора сахара C12h32O11
100,0650С. Вычислить осмотическое давление раствора при 00С. Плотность
раствора принять равной единице. Ответ: 271,5 кПа.
23 Раствор 55,4 г неэлектролита в 2,5 л воды кипит при 100,160С. Чему
равна молекулярная масса неэлектролита? Ответ: 72,0.
24 Повышение температуры кипения раствора 0,94 г фенола С6Н5ОН в
50 г этилового спирта (Е=1,16 град) 0,2320С. Найти молекулярную массу
фенола. Ответ: 94.
25 Раствор 15г хлороформа в 400г диэтилового эфира (Е=2,02 град)
кипит при температуре, превышающей температуру кипения растворителя на
0,635 °C. Вычислите молекулярную массу хлороформа. Ответ: 119,3.
26 При какой температуре должен кипеть раствор, содержащий
0,062моль неэлектролита в 200 мл воды? Ответ: 100,160С.
27 Раствор, содержащий 2,3 г С3Н8О3 в 100г ацетона (Ткип.=56,30С),
кипит при 56,730С. Найдите Е для ацетона. Ответ: 1,720С.
28 Сколько граммов сахара С12h32O11 надо растворить в 100 г воды,
чтобы а) повысить температуру кипения на 1 градус? б) Понизить
температуру замерзания на 1 град? Ответ: а) 65,8 г; б) 18,4 г.
29 При растворении 13 г неэлектролита в 400 г диэтилового эфира
(С2Н5)2O температура кипения повысилась на 0,453 градуса. Определить
молекулярную массу растворенного вещества. Ответ: 145.
30 Температура кипения водного раствора сахара C12h32O11 равна
101,40С. Вычислить моляльность раствора. При какой температуре замерзает
этот раствор? Ответ: 2 моль/кг; -3,720С.
31 Вычислить понижение температуры замерзания раствора,
содержащего 0,2 моль растворенного вещества в 750 г бензола (К=5,12 град).
Ответ: 1,365 град.
32 Температура замерзания уксусной кислоты 16,650С, а К=3,9 град.
Вычислить температуру замерзания раствора, содержащего 0,1 моль
растворенного вещества в 150 г уксусной кислоты. Ответ: 14,050С.
Ответ: 14,050С.
33 Вычислить температуру замерзания 10%-ного водного раствора
глюкозы С6Н12О6. Ответ: -1,0480С.
34 Температура замерзания бензола 5,50С. Криоскопическая константа
5,12 град. Сколько молей растворенного вещества содержится в 125 г
бензола, если раствор замерзает при 4,990С? Ответ: 0,012 моль.
35 Сколько глицерина С3Н8О3 нужно растворить в 200 г воды, чтобы
раствор замерзал при -1
0С? Ответ: 9,9 г.
36 Водный раствор сахара замерзает при -1,050С. Сколько процентов
сахара содержит этот раствор, если молекулярная масса сахара 342?
Ответ:16,2%
37 Раствор, содержащий 1,74 г растворенного вещества в 45,0 г воды,
замерзает при -1,20С. Вычислить молекулярную массу растворенного
вещества. Ответ: 60.
38 Антифризы – жидкости с пониженной температурой замерзания,
применяемые в системах охлаждения двигателей. Вычислить количество
этиленгликоля С2Н4(ОН)2 которое необходимо прибавить к 1 кг воды для
приготовления антифриза с температурой замерзания -150С. Ответ: 500 г.
Ответ: 500 г.
39 При растворении 0,502 г ацетона (СН3)2 CO в 100 г уксусной
кислоты температура замерзания понижается на 0,3390C. Вычислить
криоскопическую константу уксусной кислоты. Ответ: 3,92 град.
40 Сколько граммов нафталина С10Н8 содержится в 3 кг бензола, если
раствор замерзает при 4,550С? Т.зам. бензола 5,50С, а К=5,1 град. Ответ:71,5г.
41 В 250 г воды растворено 1,6 г некоторого неэлектролита.
Температура замерзания раствора -0,20С. Вычислить молекулярную массу
неэлектролита. Ответ: 59,5.
42 Раствор, содержащий 6 г мочевины в 50 г воды, замерзает при
-3,720С. Вычислить молекулярную массу мочевины. Ответ: 60.
43 Для приготовления охлаждающей жидкости на 20 л воды взято 6 л
глицерина С3Н8О3. Чему равна температура замерзания приготовленной
смеси? Плотность глицерина равна 1,26 г/мл. Ответ: -7,560С.
44 Формалин, уксусная кислота и глюкоза имеют одинаковый
элементарный состав: С – 39,97%; Н – 6,73% и О – 53,30%. Приготовлены
три раствора: по 1,5 г каждого из перечисленных веществ на 25 г воды.
Температура замерзания растворов равны: первого – 3,72 °C, второго -1,860С
и третьего – 0,620С, Вывести молекулярные формулы указанных веществ.
Ответ: Формалин СН2O; уксусная кислота СН3СOOН; глюкоза С6Н12O6.
45 Раствор 1,05 г неэлектролита в 30 г воды замерзает при -0,70С.
Вычислите молекулярную массу неэлектролита. Ответ: 92,5.
46 Какова температура замерзания раствора неэлектролита,
содержащего 2,02∙1023 молекул в литре воды? Ответ: -0,620С.
47 Определите формулу вещества, содержащего 39,34% углерода,
8,20% водорода и 52,46% серы, если раствор 0,2 г этого вещества в 26 г
бензола замерзает при температуре на 0,3180С ниже, чем чистый бензол.
Oтвет: C4h20S2.
48 Понижение температуры замерзания раствора 0,052 г камфоры в 26г
бензола равно 0,0670C. Рассчитайте молекулярную массу камфоры.
Ответ:152,2.
49 Для приготовления охлаждающей жидкости на 30 л воды взято 9 л
глицерина С3Н8О3. Чему равна температура замерзания приготовленного
раствора? Плотность глицерина равна 1,261 г/мл.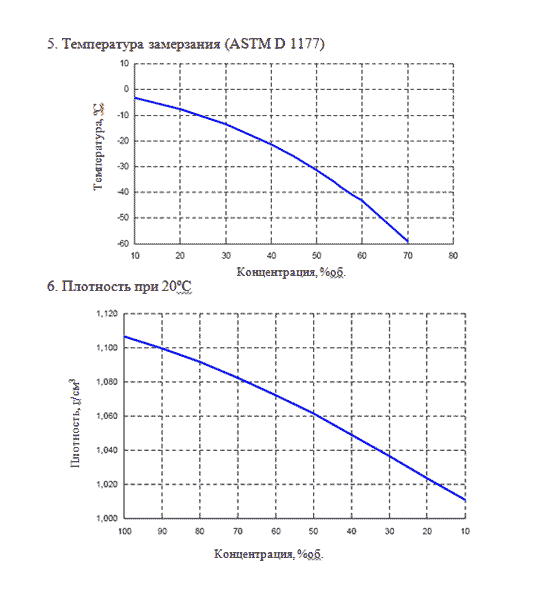 Ответ: 7,60С.
Ответ: 7,60С.
50 При какой температуре будет замерзать 25%-ный раствор этилового
спирта С2Н5ОН в воде? Ответ: -13,40С.
51 При какой температуре будет замерзать раствор, содержащий в 4 л
воды 500 г этиленгликоля С2Н4(ОН)2? Ответ: -3,730C.
52 Сколько граммов нафталина С10Н8 находится в 8 кг бензола, если
этот раствор замерзает при 3,4 50С? Температура замерзания чистого бензола
5,400С. Ответ: 392 г.
53 Вычислить процентное содержание сахара С12Н22О11 в водном
растворе, температура замерзания которого -0,410С. Ответ: 7%.
54 Вычислить температуру замерзания водного раствора мочевины
СО(Nh3)2 , в котором на 100 молей воды приходится 1 моль растворенного
вещества. Ответ: -1,0330С.
55 Раствор сахара С12h32O11 оказывает при 270C осмотическое
давление, равное 156 кПа. Принимая плотность раствора равной единице,
вычислить температуру его замерзания. Ответ: -0,1190С.
56 В каком количестве воды следует растворить 0,5 кг глицерина
С3H8O3 для получения раствора с температурой замерзания – 3
0С?
Ответ:3,37кг.
57 При растворении 0,4 г некоторого вещества в 10 г воды температура
замерзания раствора понижается на 1,240C. Вычислить молекулярную массу
растворенного вещества. Ответ: 60.
58 Водный раствор глицерина замерзает при температуре -2,790С.
Вычислить число молей глицерина, приходящихся на каждые 100 молей
воды, и давление пара раствора при 200С. Давление пара воды при 200С
равно 2,34 кПа. Ответ: 2,7 моля.
59 Раствор сахара в воде показывает повышение температуры кипения
на 0,312 °С. Вычислить величину понижения температуры замерзания этого
раствора. Ответ: 1,116 °С.
60 Давление пара водного раствора глицерина составляет 98% от
давления пара воды при той же температуре. Вычислить процентное
содержание глицерина в растворе и температуру кристаллизации раствора.
Ответ: 9,44%; -2,10С.
1 Степень диссоциации HCl в растворе, содержащем 7,3 г HCl в 200 г
воды, равна 78%. Вычислить температуру кипения раствора. Ответ: 100,93?С.
2 Осмотическое давление 0,01 н. раствора KCl при 0? с равно 0,44 атм.
раствора KCl при 0? с равно 0,44 атм.
Вычислить степень диссоциации KCl в растворе. Ответ: 96%.
3. Температура кипения раствора, содержащего 9,09 г KNO3 в 100 г
воды, равна 100,800С. Вычислить степень диссоциации KNO3 в растворе.
Ответ: 70%.
4 Раствор, содержащий 3,00 г MgCl2 в 125 г воды, замерзает при
-1,230С. Вычислить степень диссоциации MgCl2 в растворе. Ответ: 81%.
5 Осмотическое давление при 00 С раствора, содержащего 0,050 г KNO3
в 100 мл раствора, равно 166,6 мм рт. ст. Вычислить степень диссоциации
KNO3 в растворе. Ответ: 95%.
6 Раствор, содержащий 0,636 г Na2CO3 в120 г воды, замерзает при
-0,2250С. Вычислить степень диссоциации Na2CO3 в растворе. Ответ:0,7.
7 5%-ный раствор KOH кипит при 100,860С. Вычислить степень
диссоциации KOH в растворе. Ответ: 0,75.
8 Степень диссоциации MgCl2 в растворе, содержащем 0,25 моль MgCl2
в 1000 г воды, равна 0,84. Во сколько раз понижение температуры замерзания
этого раствора больше понижения температуры замерзания эквимолярного
раствора неэлектролита? Ответ: 2,68.
9 Степень диссоциации HCl в 0,02 М растворе равна 0,922. Вычислить
осмотическое давление раствора при 0?С. Ответ: 654 мм рт. ст.
10 Степень диссоциации HBr в 0,05 н. растворе равна 0,889. Вычислить
осмотическое давление раствора при 20?С. Ответ: 2,27 атм.
11 Степень диссоциации KCl в растворе, содержащем 0,02 моль KCl в
10 л воды, равна 0,969. Вычислить в миллиметрах ртутного столба
осмотическое давление раствора при 18?С. Ответ: 71,4 мм. рт. ст.
12 Степень диссоциации K2SO4 в растворе, содержащем 0,026 моль
K2SO4 в 50,0 г воды, равна 53%. Вычислить повышение температуры кипения
раствора. Ответ: 0,5550С.
13 Степень диссоциации Na2CO3 в растворе, содержащем 0,01 моль
Na2CO3 в 200 г воды, равна 0,70. Вычислить температуру замерзания
раствора. Ответ: — 0,220С.
14 Степень диссоциации CaCl2 в растворе, содержащем 0,666 г CaCl2 в
125 г воды, равна 75%. Вычислить температуру замерзания раствора.
Ответ: -0,220С.
15 Раствор KIO3, в 500 мл которого содержится 5,35 г соли, оказывает
при 17,5?С осмотическое давление, равное 2,18 атм. Вычислить коэффициент
Вычислить коэффициент
i и кажущуюся степень диссоциации соли в растворе. Ответ: 1,83; 0,83.
16 В каком объеме раствора должен быть растворен 1 моль сахара,
чтобы раствор был изотоничен с 0,1 н. раствором LiCl, кажущаяся степень
диссоциации которого в растворе равна 0,9? Ответ: 5,26 л.
17 Вычислить молярность раствора некоторого неэлектролита,
изотоничного 0,05 н. раствору Pb(NO3)2. Кажущаяся степень диссоциации
соли в растворе 0,72. Ответ: 0,061 моль/л.
18 Вычислить давление пара 10%-ного раствора Ba(NO3)2 при 280С.
Давление пара воды при той же температуре составляет 28,35 мм рт. ст.
Кажущаяся степень диссоциации соли 0,575. Ответ: 27,89 мм рт. ст.
19 Давление пара раствора, содержащего 16,72 Ca(NO3)2 в 250 г воды,
составляет 14,28 мм рт. ст. при 170С. Вычислить кажущуюся степень
диссоциации соли, если известно, что давление пара воды при той же
температуре составляет 14,53 мм рт. ст. Ответ: 0,69.
20 Давление пара 4%-ного раствора KCl составляет 17,23 мм рт. ст.
ст.
Вычислить осмотическое давление раствора при 200С, если плотность его
равна 1,026. Ответ: 23,5 атм.
21 Раствор, содержащий 33,2 г Ba(NO3)2 в 300 г воды, кипит при
100,4660С. Вычислить кажущуюся степень диссоциации соли в растворе.
Ответ: 0,56.
22 Раствор KNO3, содержащий 8,44% соли, показывает прирост
температуры кипения на 0,7970
по сравнению с температурой кипения воды.
Вычислить кажущуюся степень диссоциации соли в растворе. Ответ: 0,68.
23 Кажущаяся степень диссоциации соли в 3,2%-ном растворе KCl
составляет 0,68. Вычислить температуру кипения раствора. Ответ: 100,3870С.
24 Давление пара раствора, приготовленного из 0,408 моля Ca(NO3)2 и
1000 г воды, равно 746,9 мм рт. ст. при 100?С. Вычислить, при какой
температуре давление пара раствора достигнет 760 мм рт. ст. и раствор
закипит. Ответ: 100,5060С.
25 Раствор содержит 3,38% нитрата кальция, кажущаяся степень
диссоциации которого составляет 0,65. Вычислить: а)величину
осмотического давления раствора при 00С, приняв плотность его равной 1,01;
б)температуру кипения раствора. Ответ: а)10,72 атм; б)100,2550С.
Ответ: а)10,72 атм; б)100,2550С.
26 Если растворить 55,8 г ZnCl2 в 5кг воды, получится раствор,
кристаллизующийся при -0,3850С. Вычислить кажущуюся степень
диссоциации соли в растворе. Ответ: 0,765.
27 Вычислить кажущуюся степень диссоциации CaCl2 в растворе,
содержащем 0,0995 моля CaCl2 в 500г воды. Температура кристаллизации
такого раствора -0,7400С. Ответ: 0,50.
28 Если растворить 25,5 г BaCl2 в 750 г воды, то получится раствор,
кристаллизующийся при -0,7560С. Вычислить кажущуюся степень
диссоциации соли в растворе. Ответ: 0,74.
29 Какова температура кристаллизации раствора, содержащего 84,9 г
NaNO3 в 1000 г воды? Давление пара раствора составляет 17,02 мм рт. ст., а
давление пара воды при той же температуре -17,54 мм рт. ст. Ответ: -3,160С.
30. Вычислить осмотическое давление при 18,50С раствора, в 5 л
которого содержится 62,4 г CuSO4 5h3O. Кажущаяся степень диссоциации
соли в растворе 0,38. Ответ: 1,65 атм.
Температура замерзания антифриза: почему нельзя заливать концентрат
Основой большинства охлаждающих жидкостей является этиленгликоль. Благодаря этому веществу антифриз обладает морозостойкими свойствами. Напрашивается поверхностный вывод: чем больше будет этиленгликоля в составе, тем ниже температура замерзания антифриза.
Благодаря этому веществу антифриз обладает морозостойкими свойствами. Напрашивается поверхностный вывод: чем больше будет этиленгликоля в составе, тем ниже температура замерзания антифриза.
Но все не так просто:
Татьяна Ионкина менеджер по качеству
График показывает зависимость температуры замерзания (начала кристаллизации) водно-гликолевого раствора от концентрации этиленгликоля.
Как видно, неразбавленный этиленгликоль начинает замерзать уже при −12,9 °C. А чтобы достичь минимальной температурной отметки в –72 °С, этиленгликоль разбавляют водой в соотношении 66,7 / 33,3.
Однако антифриз — это не только вода и гликоль. В его состав входят антикоррозионные, антипенные и другие присадки. Помимо своих «прямых обязанностей», присадки также могут препятствовать образованию кристаллов льда и улучшать низкотемпературные свойства.
Подробнее о составе правильного антифриза
Факты об антифризах
Чистый этиленгликоль замерзает при −13 °C
Концентрат разбавляют водой не только для понижения температуры замерзания, но и чтобы снизить нагрузку на помпу. При разведении охлаждающая жидкость становится менее вязкой и насосу проще ее перегонять. Также неразбавленный концентрат содержит такое количество присадок, что вместо защиты от коррозии будет происходить окисление среды и, как следствие, ржавление и коррозия металлических деталей.
При разведении охлаждающая жидкость становится менее вязкой и насосу проще ее перегонять. Также неразбавленный концентрат содержит такое количество присадок, что вместо защиты от коррозии будет происходить окисление среды и, как следствие, ржавление и коррозия металлических деталей.
Наконец, разбавлять концентрат — это экономия. На выходе получаем в два раза больше охлаждающей жидкости (при разбавлении водой в пропорции 50 / 50).
Рекомендации по разбавлению концентрата антифриза на основе карты средних и максимальных температур
PEAK выпускает антифризы трех видов: 50 / 50, 60 / 40 и концентрат. 50 / 50 — оптимальная концентрация для центральной части России. Большинство автопроизводителей на конвейере заливают антифриз именно в такой концентрации.
Если ваша техника работает на юге и вам достаточно концентрации 40 / 60 или если требуется «усиленный антифриз» для самых суровых условий, то вы можете разместить специальный заказ либо самостоятельно приготовить антифриз с нужной температурой замерзания при помощи концентрата.
как разбавлять
концентрат антифриза
Обязательно разбавляйте концентрат антифриза водой. Иначе вы рискуете, что радиатор и рубашка блока цилиндров лопнут на морозе.
Концентрат разводите в зависимости от температурных условий вашего региона, но важно делать это с запасом. Например, в Москве средняя январская температура: −10 °C, абсолютный минимум: −38 °C. Имеет смысл подстраховаться и залить раствор 50 / 50, особенно если вы путешествуете в более холодные регионы.
Не разводите концентрат неподготовленной водой. Неочишенная вода содержит ионы, которые будут оставлять накипь в системе охлаждения. Для разбавления антифриза подойдет дистиллированная вода или вода, очищенная в промышленных установках фильтрации.
Помните, что производитель не дает гарантий для антифриза, разбавленного в полевых условиях. Мы не можем гарантировать чистоту воды, которую вы использовали, и точность пропорции разбавления. Если вы сомневаетесь в чистоте воды или боитесь, что у вас не получится выдержать нужную пропорцию, то рекомендуем использовать готовые к применению антифризы.
Факты об антифризах
Антифриз в концентрации 50 / 50 начинает замерзать при –36 °С
Антифриз PEAK Long Life 50 / 50
50 / 50Выдерживает морозы до –36 °С
Готов к применениюАнтифриз разбавлен водой в промышленных условиях
Масса НЕТТО: 4 кгВ зависимости от концентрации, вес антифриза отличается. Например, концентрат PEAK Long Life в той же упаковке весит 4,2 кг
Всегда разбавляйте концентрат
перед заправкой системы
%PDF-1.4
%
1 0 объект
>
эндообъект
2 0 объект
>
эндообъект
3 0 объект
>
эндообъект
4 0 объект
>
/Шрифт
>
/XОбъект
>
>>
/Группа
>
>>
эндообъект
5 0 объект
>
/Шрифт
>
>>
/Группа
>
>>
эндообъект
6 0 объект
>
поток
конечный поток
эндообъект
7 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F0 -14 Тф
0 12,4756 Tд Tj
ET
Вопрос
Вопрос
конечный поток
эндообъект
8 0 объект
>
эндообъект
9 0 объект
>
эндообъект
10 0 объект
>
поток
/CIDInit /ProcSet найти ресурс начать
12 начало слова
begincmap
/CIDSystemInfo > определение
/CMapName /Adobe-Identity-UCS по определению /CMapType 2 по определению
1
endcodespacerange
46 начало
крайний край
endcmap CMapName currentdict /CMap defineresource pop end end
конечный поток
эндообъект
11 0 объект
>
/Дескриптор шрифта 9 0 R
/BaseFont/XOOEQW+TimesNewRoman,Жирный
/Вт [3[250]11[333]12[333]15[250]17[250]19[500]20[500]21[500]22[500]23[500]24[500]29[333 ]36[722]37[666]38[722]39[722]46[777]48[943]49[722]50[777]51[610]53[722]55[666]68[500]69 [556]70[443]71[556]72[443]73[333]74[500]75[556]76[277]79[277]80[833]81[556]82[500]83[556 ]84[556]85[443]86[389]87[333]88[556]89[500]90[722]92[500]93[443]]
>>
эндообъект
12 0 объект
>
эндообъект
13 0 объект
>
поток
конечный поток
эндообъект
14 0 объект
>
поток
конечный поток
эндообъект
15 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F0 -14 Тф
543 12. 4756 тд тж
4756 тд тж
ET
Вопрос
Вопрос
конечный поток
эндообъект
16 0 объект
>
поток
конечный поток
эндообъект
17 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F0 -14 Тф
0 31.2256 Тд Тж
ET
Вопрос
Вопрос
конечный поток
эндообъект
18 0 объект
>
поток
конечный поток
эндообъект
19 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F0 -14 Тф
240,75 31,2256 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
20 0 объект
>
поток
конечный поток
эндообъект
21 0 объект
>
поток
конечный поток
эндообъект
22 0 объект
>
поток
конечный поток
эндообъект
23 0 объект
>
поток
конечный поток
эндообъект
24 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
1.1 Вт
0 Дж
0 Дж
[]0 д
/GS1 г
0 0 м
0 0 л
С
Вопрос
Вопрос
конечный поток
эндообъект
25 0 объект
>
эндообъект
26 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
1,1 Вт
0 Дж
0 Дж
[]0 д
/GS1 г
6 43,5 м
606 43,5 л
С
Вопрос
Вопрос
конечный поток
эндообъект
27 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
1,1 Вт
0 Дж
0 Дж
[]0 д
/GS1 г
6 767,25 м
606 767,25 л
С
Вопрос
Вопрос
конечный поток
эндообъект
28 0 объект
>
поток
конечный поток
эндообъект
29 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
27,75 95,4434 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
30 0 объект
>
эндообъект
31 0 объект
>
поток
/CIDInit /ProcSet найти ресурс начать
12 начало слова
begincmap
/CIDSystemInfo > определение
/CMapName /Adobe-Identity-UCS по определению /CMapType 2 по определению
1
endcodespacerange
51 начало
крайний край
endcmap CMapName currentdict /CMap defineresource pop end end
конечный поток
эндообъект
32 0 объект
>
/Дескриптор шрифта 30 0 R
/BaseFont/HWPYEN+TimesNewRoman
/Вт [3[250]11[333]12[333]15[250]17[250]19[500]20[500]21[500]22[500]23[500]24[500]25[500 ]26[500]27[500]28[500]34[443]36[722]37[666]38[666]39[722]43[722]46[722]48[889]49[722]50 [722]54[556]55[610]58[943]68[443]69[500]70[443]71[500]72[443]73[333]74[500]75[500]76[277 ]79[277]80[777]81[500]82[500]83[500]84[500]85[333]86[389]87[277]88[500]89[500]90[722]92 [500]93[443]]
>>
эндообъект
33 0 объект
>
эндообъект
34 0 объект
>
поток
конечный поток
эндообъект
35 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
45.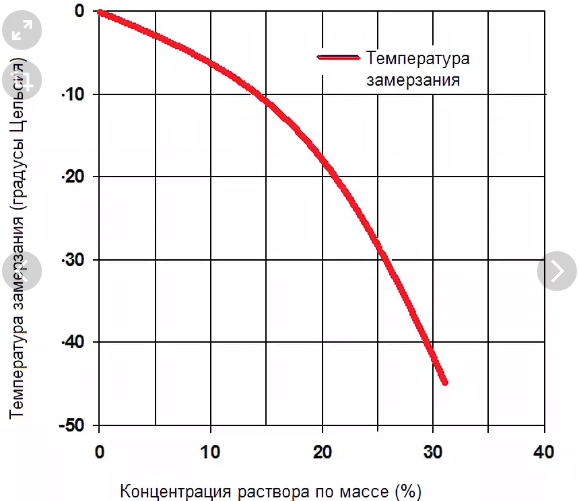 75 95.4434 Тд Тж
75 95.4434 Тд Тж
ET
Вопрос
Вопрос
конечный поток
эндообъект
36 0 объект
>
поток
конечный поток
эндообъект
37 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
27,75 111,1934 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
38 0 объект
>
поток
конечный поток
эндообъект
39 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
45,75 111,1934 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
40 0 объект
>
поток
конечный поток
эндообъект
41 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -8,4 тс
92,25 111,7354 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
42 0 объект
>
поток
конечный поток
эндообъект
43 0 объект
>
поток
конечный поток
эндообъект
44 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
96.75 111.1934 Тд Тж
ET
Вопрос
Вопрос
конечный поток
эндообъект
45 0 объект
>
поток
конечный поток
эндообъект
46 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -8,4 тс
112,5 111,7354 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
47 0 объект
>
поток
конечный поток
эндообъект
48 0 объект
>
поток
конечный поток
эндообъект
49 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
117 111. 1934 Тд Тж
1934 Тд Тж
ET
Вопрос
Вопрос
конечный поток
эндообъект
50 0 объект
>
поток
конечный поток
эндообъект
51 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F0 -12 Тф
150.75 95.4434 Тд Тж
ET
Вопрос
Вопрос
конечный поток
эндообъект
52 0 объект
>
поток
конечный поток
эндообъект
53 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F0 -11 Тф
168,75 94,5522 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
54 0 объект
>
поток
конечный поток
эндообъект
55 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F0 -7,7 тс
212,25 94,6116 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
56 0 объект
>
поток
конечный поток
эндообъект
57 0 объект
>
поток
конечный поток
эндообъект
58 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F0 -11 Тф
216 94.5522 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
59 0 объект
>
поток
конечный поток
эндообъект
60 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F0 -7,7 тс
231,75 94,6116 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
61 0 объект
>
поток
конечный поток
эндообъект
62 0 объект
>
поток
конечный поток
эндообъект
63 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F0 -11 Тф
235,5 94,5522 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
64 0 объект
>
поток
конечный поток
эндообъект
65 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
150.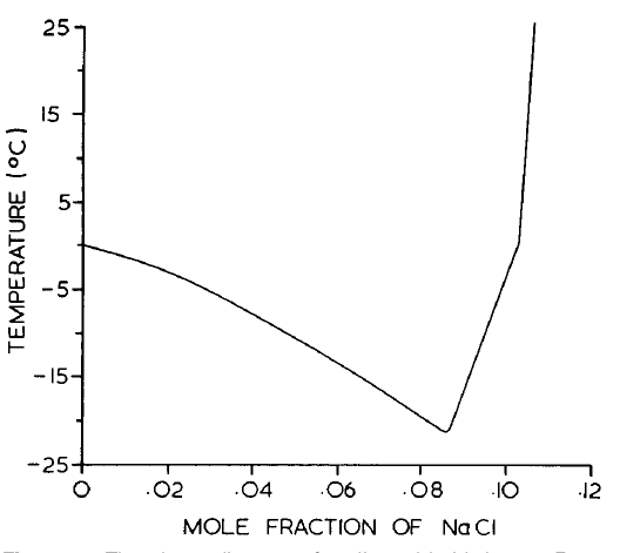 75 111.1934 Тд Тж
75 111.1934 Тд Тж
ET
Вопрос
Вопрос
конечный поток
эндообъект
66 0 объект
>
поток
конечный поток
эндообъект
67 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
168,75 111,1934 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
68 0 объект
>
поток
конечный поток
эндообъект
69 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -8,4 тс
232,5 111,7354 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
70 0 объект
>
поток
конечный поток
эндообъект
71 0 объект
>
поток
конечный поток
эндообъект
72 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
237 111.1934 Td Tj
ET
Вопрос
Вопрос
конечный поток
эндообъект
73 0 объект
>
поток
конечный поток
эндообъект
74 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
15 60.1934 Тд Тж
ET
Вопрос
Вопрос
конечный поток
эндообъект
75 0 объект
>
поток
конечный поток
эндообъект
76 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
27,75 60,1934 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
77 0 объект
>
поток
конечный поток
эндообъект
78 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
27,75 74,4434 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
79 0 объект
>
поток
конечный поток
эндообъект
80 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
27.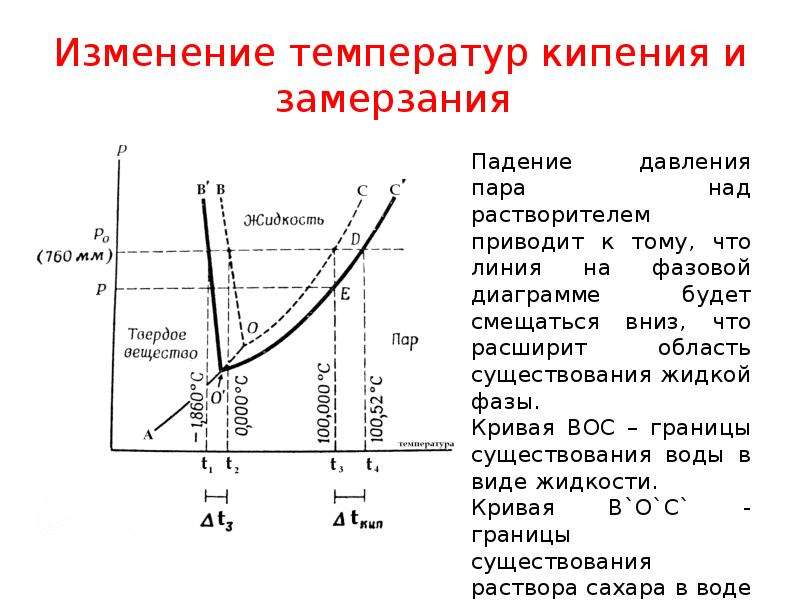 75 208,6934 Тд Тдж
75 208,6934 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
81 0 объект
>
поток
конечный поток
эндообъект
82 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
45,75 208,6934 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
83 0 объект
>
поток
конечный поток
эндообъект
84 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
45,75 222,9434 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
85 0 объект
>
поток
конечный поток
эндообъект
86 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
27,75 238,6934 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
87 0 объект
>
поток
конечный поток
эндообъект
88 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
45.75 238,6934 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
89 0 объект
>
поток
конечный поток
эндообъект
90 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
45,75 252,9434 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
91 0 объект
>
поток
конечный поток
эндообъект
92 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
27,75 268,6934 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
93 0 объект
>
поток
конечный поток
эндообъект
94 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
45,75 268,6934 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
95 0 объект
>
поток
конечный поток
эндообъект
96 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
45. 75 282,9434 Тд Тдж
75 282,9434 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
97 0 объект
>
поток
конечный поток
эндообъект
98 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F0 -12 Тф
27,75 298,6934 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
99 0 объект
>
поток
конечный поток
эндообъект
100 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F0 -11 Тф
45,75 297,8022 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
101 0 объект
>
поток
конечный поток
эндообъект
102 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F0 -11 Тф
45,75 310,5522 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
103 0 объект
>
поток
конечный поток
эндообъект
104 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
15 144.9434 тд тж
ET
Вопрос
Вопрос
конечный поток
эндообъект
105 0 объект
>
поток
конечный поток
эндообъект
106 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
27,75 144,9434 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
107 0 объект
>
поток
конечный поток
эндообъект
108 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
27,75 159,1934 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
109 0 объект
>
поток
конечный поток
эндообъект
110 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
27,75 173,4434 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
111 0 объект
>
поток
конечный поток
эндообъект
112 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
27. 75 187,6934 Тд Тдж
75 187,6934 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
113 0 объект
>
поток
конечный поток
эндообъект
114 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
27,75 396,1934 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
115 0 объект
>
поток
конечный поток
эндообъект
116 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
45,75 396,1934 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
117 0 объект
>
поток
конечный поток
эндообъект
118 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
27,75 411,9434 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
119 0 объект
>
поток
конечный поток
эндообъект
120 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
45.75 411.9434 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
121 0 объект
>
поток
конечный поток
эндообъект
122 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
27,75 427,6934 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
123 0 объект
>
поток
конечный поток
эндообъект
124 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
45,75 427,6934 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
125 0 объект
>
поток
конечный поток
эндообъект
126 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F0 -12 Тф
27,75 443,4434 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
127 0 объект
>
поток
конечный поток
эндообъект
128 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F0 -11 Тф
45.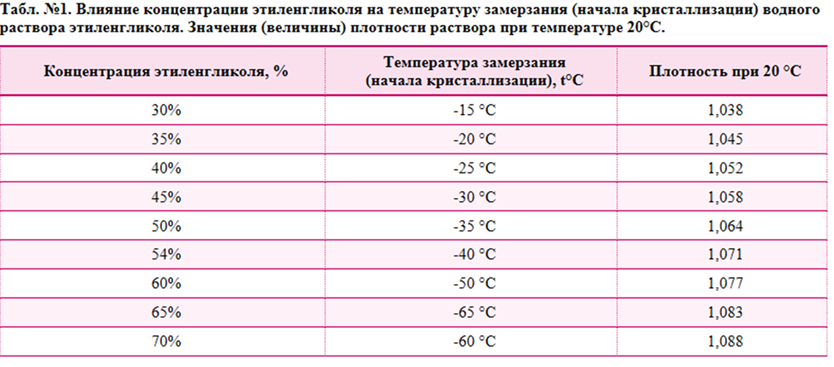 75 442,5522 Тд Тдж
75 442,5522 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
129 0 объект
>
поток
конечный поток
эндообъект
130 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
15 346,6934 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
131 0 объект
>
поток
конечный поток
эндообъект
132 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
27,75 346,6934 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
133 0 объект
>
поток
конечный поток
эндообъект
134 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
27,75 360,9434 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
135 0 объект
>
поток
конечный поток
эндообъект
136 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
27.75 375,1934 Тд Тж
ET
Вопрос
Вопрос
конечный поток
эндообъект
137 0 объект
>
поток
конечный поток
эндообъект
138 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
27,75 512,4434 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
139 0 объект
>
поток
конечный поток
эндообъект
140 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
45,75 512,4434 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
141 0 объект
>
поток
конечный поток
эндообъект
142 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
45,75 526,6934 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
143 0 объект
>
поток
конечный поток
эндообъект
144 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
27. 75 542,4434 Тд Тдж
75 542,4434 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
145 0 объект
>
поток
конечный поток
эндообъект
146 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
45,75 542,4434 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
147 0 объект
>
поток
конечный поток
эндообъект
148 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
45,75 556,6934 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
149 0 объект
>
поток
конечный поток
эндообъект
150 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F0 -12 Тф
27,75 572,4434 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
151 0 объект
>
поток
конечный поток
эндообъект
152 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F0 -11 Тф
45.75 571,5522 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
153 0 объект
>
поток
конечный поток
эндообъект
154 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F0 -11 Тф
45,75 584,3022 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
155 0 объект
>
поток
конечный поток
эндообъект
156 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
27,75 602,4434 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
157 0 объект
>
поток
конечный поток
эндообъект
158 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
45,75 602,4434 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
159 0 объект
>
поток
конечный поток
эндообъект
160 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
45. 75 616,6934 Тд Тдж
75 616,6934 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
161 0 объект
>
поток
конечный поток
эндообъект
162 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
15 477.1934 Тд Тж
ET
Вопрос
Вопрос
конечный поток
эндообъект
163 0 объект
>
поток
конечный поток
эндообъект
164 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
27,75 477,1934 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
165 0 объект
>
поток
конечный поток
эндообъект
166 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
27,75 491,4434 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
167 0 объект
>
поток
конечный поток
эндообъект
168 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
27.75 685,6934 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
169 0 объект
>
поток
конечный поток
эндообъект
170 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
45,75 685,6934 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
171 0 объект
>
поток
конечный поток
эндообъект
172 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
27,75 701,4434 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
173 0 объект
>
поток
конечный поток
эндообъект
174 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
45,75 701,4434 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
175 0 объект
>
поток
конечный поток
эндообъект
176 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F0 -12 Тф
27. 75 717.1934 Тд Тж
75 717.1934 Тд Тж
ET
Вопрос
Вопрос
конечный поток
эндообъект
177 0 объект
>
поток
конечный поток
эндообъект
178 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F0 -11 Тф
45,75 716,3022 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
179 0 объект
>
поток
конечный поток
эндообъект
180 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
27,75 732,9434 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
181 0 объект
>
поток
конечный поток
эндообъект
182 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
45,75 732,9434 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
183 0 объект
>
поток
конечный поток
эндообъект
184 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
15 650.4434 тд тж
ET
Вопрос
Вопрос
конечный поток
эндообъект
185 0 объект
>
поток
конечный поток
эндообъект
186 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
27,75 650,4434 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
187 0 объект
>
поток
конечный поток
эндообъект
188 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
27,75 664,6934 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
189 0 объект
>
поток
конечный поток
эндообъект
190 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F0 -12 Тф
327,75 95,4434 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
191 0 объект
>
поток
конечный поток
эндообъект
192 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F0 -11 Тф
345. 75 94.5522 Тд Тдж
75 94.5522 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
193 0 объект
>
поток
конечный поток
эндообъект
194 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
327,75 111,1934 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
195 0 объект
>
поток
конечный поток
эндообъект
196 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
345,75 111,1934 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
197 0 объект
>
поток
конечный поток
эндообъект
198 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
450,75 95,4434 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
199 0 объект
>
поток
конечный поток
эндообъект
200 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
468.75 95.4434 Тд Тж
ET
Вопрос
Вопрос
конечный поток
эндообъект
201 0 объект
>
поток
конечный поток
эндообъект
202 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
450,75 111,1934 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
203 0 объект
>
поток
конечный поток
эндообъект
204 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
468,75 111,1934 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
205 0 объект
>
поток
конечный поток
эндообъект
206 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
315 60. 1934 Тд Тж
1934 Тд Тж
ET
Вопрос
Вопрос
конечный поток
эндообъект
207 0 объект
>
поток
конечный поток
эндообъект
208 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
327.75 60.1934 Тд Тж
ET
Вопрос
Вопрос
конечный поток
эндообъект
209 0 объект
>
поток
конечный поток
эндообъект
210 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -8,4 тс
524,25 60,7354 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
211 0 объект
>
поток
конечный поток
эндообъект
212 0 объект
>
поток
конечный поток
эндообъект
213 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
528,75 60,1934 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
214 0 объект
>
поток
конечный поток
эндообъект
215 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
327.75 74.4434 Тд Тж
ET
Вопрос
Вопрос
конечный поток
эндообъект
216 0 объект
>
поток
конечный поток
эндообъект
217 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F2 -12 Тф
364,5 74,4434 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
218 0 объект
>
эндообъект
219 0 объект
>
поток
/CIDInit /ProcSet найти ресурс начать
12 начало слова
begincmap
/CIDSystemInfo > определение
/CMapName /Adobe-Identity-UCS по определению /CMapType 2 по определению
1
endcodespacerange
6 начало
крайний край
endcmap CMapName currentdict /CMap defineresource pop end end
конечный поток
эндообъект
220 0 объект
>
/Дескриптор шрифта 218 0 R
/BaseFont/GXWEXU+TimesNewRoman, Курсив
/Вт [72[443]79[277]82[500]86[389]87[277]90[666]]
>>
эндообъект
221 0 объект
>
эндообъект
222 0 объект
>
поток
конечный поток
эндообъект
223 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
395.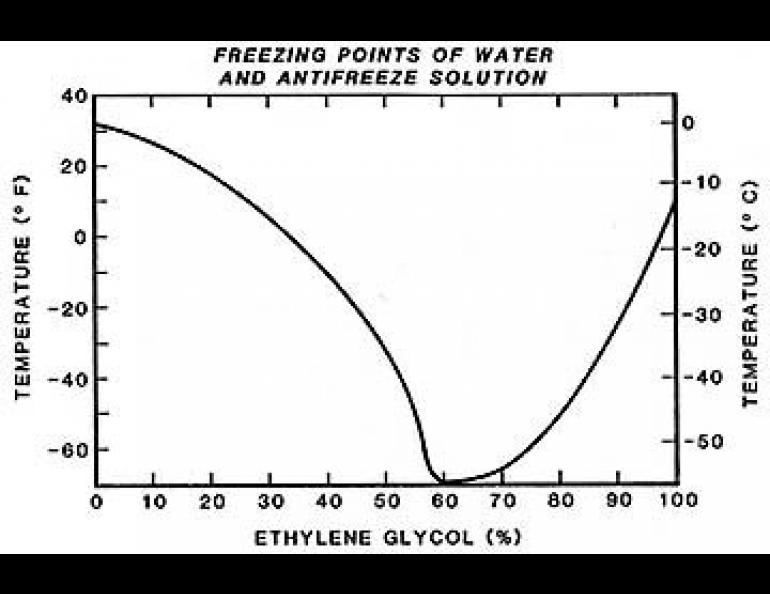 25 74.4434 Тд Тж
25 74.4434 Тд Тж
ET
Вопрос
Вопрос
конечный поток
эндообъект
224 0 объект
>
поток
конечный поток
эндообъект
225 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
327,75 165,9434 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
226 0 объект
>
поток
конечный поток
эндообъект
227 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
345,75 165,9434 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
228 0 объект
>
поток
конечный поток
эндообъект
229 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
327,75 181,6934 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
230 0 объект
>
поток
конечный поток
эндообъект
231 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
345.75 181,6934 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
232 0 объект
>
поток
конечный поток
эндообъект
233 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F0 -12 Тф
327,75 197,4434 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
234 0 объект
>
поток
конечный поток
эндообъект
235 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F0 -11 Тф
345,75 196,5522 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
236 0 объект
>
поток
конечный поток
эндообъект
237 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
327,75 213,1934 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
238 0 объект
>
поток
конечный поток
эндообъект
239 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
345. 75 213.1934 Тд Тж
75 213.1934 Тд Тж
ET
Вопрос
Вопрос
конечный поток
эндообъект
240 0 объект
>
поток
конечный поток
эндообъект
241 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
315 144,9434 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
242 0 объект
>
поток
конечный поток
эндообъект
243 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
327,75 144,9434 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
244 0 объект
>
поток
конечный поток
эндообъект
245 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F2 -12 Тф
488,25 144,9434 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
246 0 объект
>
поток
конечный поток
эндообъект
247 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
519 144.9434 тд тж
ET
Вопрос
Вопрос
конечный поток
эндообъект
248 0 объект
>
поток
конечный поток
эндообъект
249 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
327,75 267,9434 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
250 0 объект
>
поток
конечный поток
эндообъект
251 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
345,75 267,9434 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
252 0 объект
>
поток
конечный поток
эндообъект
253 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
345,75 282,1934 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
254 0 объект
>
поток
конечный поток
эндообъект
255 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
327.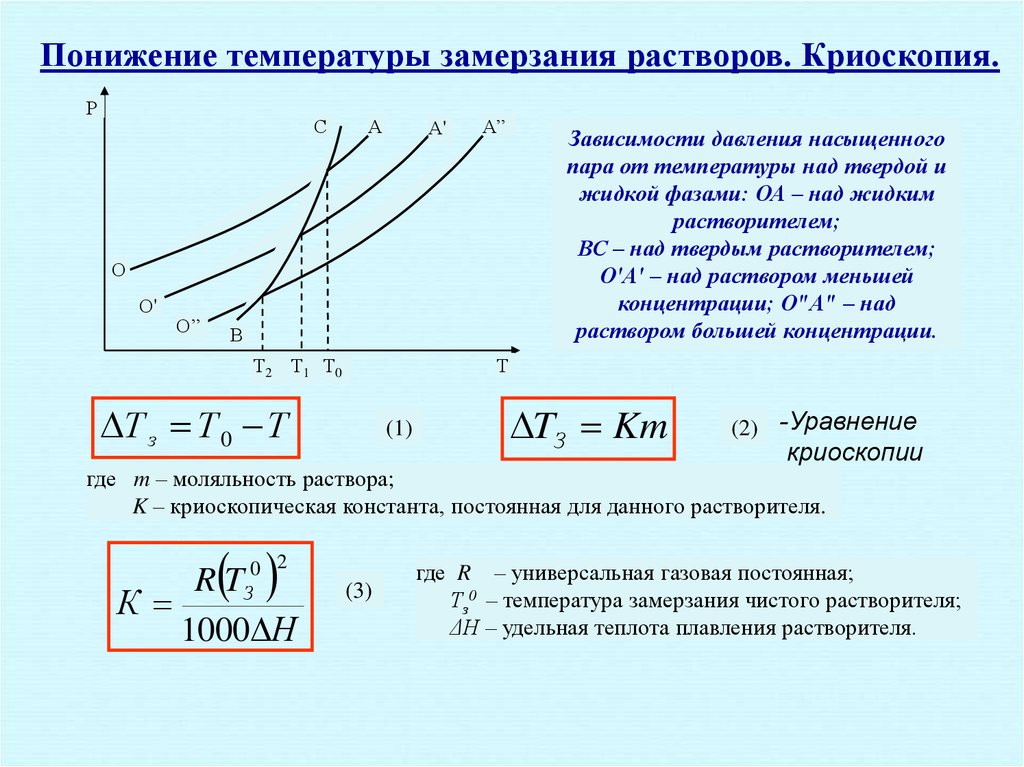 75 297,9434 Тд Тдж
75 297,9434 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
256 0 объект
>
поток
конечный поток
эндообъект
257 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
345,75 297,9434 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
258 0 объект
>
поток
конечный поток
эндообъект
259 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
345,75 312,1934 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
260 0 объект
>
поток
конечный поток
эндообъект
261 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F0 -12 Тф
327,75 327,9434 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
262 0 объект
>
поток
конечный поток
эндообъект
263 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F0 -11 Тф
345.75 327.0522 Тд Тж
ET
Вопрос
Вопрос
конечный поток
эндообъект
264 0 объект
>
поток
конечный поток
эндообъект
265 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F0 -11 Тф
345,75 339,8022 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
266 0 объект
>
поток
конечный поток
эндообъект
267 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
327,75 357,9434 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
268 0 объект
>
поток
конечный поток
эндообъект
269 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
345,75 357,9434 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
270 0 объект
>
поток
конечный поток
эндообъект
271 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
345. 75 372,1934 Тд Тж
75 372,1934 Тд Тж
ET
Вопрос
Вопрос
конечный поток
эндообъект
272 0 объект
>
поток
конечный поток
эндообъект
273 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
315 246,9434 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
274 0 объект
>
поток
конечный поток
эндообъект
275 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
327,75 246,9434 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
276 0 объект
>
поток
конечный поток
эндообъект
277 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
БТ
/GS0 г
/F1 -12 Тф
327,75 441,1934 Тд Тдж
ET
Вопрос
Вопрос
конечный поток
эндообъект
278 0 объект
>
поток
д
1 0 0 -1 0 792 см -100 Тз
д
51.75 0 0 -7,5 345,75 438 см /I0 Do Q
Вопрос
Вопрос
конечный поток
эндообъект
279 0 объект
>
поток
x](
Депрессия точки замерзания
Депрессия точки замерзания
Депрессия точки замерзания
Температура замерзания раствора ниже температуры замерзания чистого растворителя. Это означает, что раствор должен быть охлажден до более низкой температуры, чем чистый растворитель, чтобы произошло замерзание.
Температура замерзания растворителя в растворе изменяется по мере изменения концентрации растворенного вещества в растворе (но она не зависит от идентичности растворителя или частиц растворенного вещества (типа, размера или заряда) в растворе. ).
Нелетучие растворенные вещества
Температура замерзания растворителя в растворе будет ниже точки замерзания чистого растворителя независимо от того, содержит ли раствор нелетучие или летучие растворенные вещества. Однако для простоты здесь будут рассматриваться только нелетучие растворенные вещества.
Экспериментально известно, что изменение температуры замерзания растворителя в растворе по сравнению с чистым растворителем прямо пропорционально молярной концентрации растворенного вещества:
T = K f m
где:
T изменение температуры замерзания растворителя,
K b — молярная константа понижения температуры замерзания , а
м – молярная концентрация растворенного вещества в растворе.
Обратите внимание, что молярная константа понижения температуры замерзания, K f , имеет конкретное значение, зависящее от типа растворителя.
| растворитель | нормальная температура замерзания, o C | К б , о С м -1 |
| вода | 0,0 | 1,86 |
| уксусная кислота | 16.6 | 3,9 |
| бензол | 5,5 | 5.12 |
| хлороформ | -63,5 | 4,68 |
| нитробензол | 5,67 | 8. 1 1 |
На следующем графике показана нормальная точка замерзания воды (растворителя) в зависимости от моляльности в нескольких растворах, содержащих сахарозу (нелетучее растворенное вещество).Обратите внимание, что нормальная температура замерзания воды снижается по мере увеличения концентрации сахарозы.
Точка замерзания — MCAT Физический
Если вы считаете, что контент, доступный с помощью Веб-сайта (как это определено в наших Условиях обслуживания), нарушает одно
или более ваших авторских прав, пожалуйста, сообщите нам, предоставив письменное уведомление («Уведомление о нарушении»), содержащее
в
информацию, описанную ниже, назначенному агенту, указанному ниже.Если университетские наставники примут меры в ответ на
ан
Уведомление о нарушении, он предпримет добросовестную попытку связаться со стороной, предоставившей такой контент
средства самого последнего адреса электронной почты, если таковой имеется, предоставленного такой стороной Varsity Tutors.
Ваше Уведомление о нарушении может быть направлено стороне, предоставившей контент, или третьим лицам, таким как
так как
ChillingEffects.org.
Обратите внимание, что вы будете нести ответственность за ущерб (включая расходы и гонорары адвокатов), если вы существенно
искажать информацию о том, что продукт или деятельность нарушают ваши авторские права.Таким образом, если вы не уверены, что содержимое находится
на Веб-сайте или на который ссылается Веб-сайт, нарушает ваши авторские права, вам следует сначала обратиться к адвокату.
Чтобы подать уведомление, выполните следующие действия:
Вы должны включить следующее:
Физическая или электронная подпись владельца авторских прав или лица, уполномоченного действовать от его имени;
Идентификация авторских прав, которые, как утверждается, были нарушены;
Описание характера и точного местонахождения контента, который, как вы утверждаете, нарушает ваши авторские права, в \
достаточно подробно, чтобы преподаватели университета могли найти и точно идентифицировать этот контент; например, мы требуем
а
ссылку на конкретный вопрос (а не только название вопроса), который содержит содержание и описание
к какой конкретной части вопроса — изображению, ссылке, тексту и т. д. — относится ваша жалоба;
д. — относится ваша жалоба;
Ваше имя, адрес, номер телефона и адрес электронной почты; а также
Заявление от вас: (а) что вы добросовестно полагаете, что использование контента, который, как вы утверждаете, нарушает
ваши авторские права не разрешены законом или владельцем авторских прав или его агентом; б) что все
информация, содержащаяся в вашем Уведомлении о нарушении, является точной, и (c) под страхом наказания за лжесвидетельство вы
либо владельцем авторских прав, либо лицом, уполномоченным действовать от их имени.
Отправьте жалобу нашему назначенному агенту по адресу:
Чарльз Кон
Varsity Tutors LLC
101 S. Hanley Rd, Suite 300
St. Louis, MO 63105
Или заполните форму ниже:
Замораживание и кипячение
Замораживание и кипячение
Повышение температуры кипения/точка замерзания
Депрессия
Снижение давления паров вещества имеет очевидный эффект
по температуре кипения; температура кипения повышается. АД повышается, потому что
АД повышается, потому что
требуется больше энергии, чтобы давление паров растворителя достигло
внешнее давление.
Логика/рисунок, который использовался для объяснения давления паров
понижение может быть использовано для объяснения изменения температуры кипения. Там
меньше молекул растворителя на поверхности способны к испарению, поэтому
давление пара падает. Таким образом, температура кипения
должно быть увеличено.
Другим последствием пониженного давления пара является уменьшение
Точка замерзания.Это тоже можно объяснить картинкой.
Вместо изучения границы пар-жидкость мы
посмотрите на границу раздела твердое тело-жидкость.
При нормальной температуре плавления твердого вещества определяется для материалов ниже 1
банкомат давления как температуры, при которой твердое тело находится в
равновесие с жидкостью.
При температуре замерзания скорость плавления твердого вещества равна
к скорости замерзания жидкости A . Если растворенное вещество
введенная скорость, при которой твердое тело плавится, не меняется, а
поскольку рядом с твердым телом находится меньше молекул жидкости, скорость при
которых жидкость замерзает каплями—( B ) три молекулы плавятся и
замерзает только одно — равновесия больше нет, и твердое тело
тает. Для восстановления равновесия скорость, с которой твердое тело
Для восстановления равновесия скорость, с которой твердое тело
расплавы должны быть снижены; т. е. температура должна быть снижена.
Изменение как точки замерзания, так и точки кипения
прямо пропорциональна количеству вещества, растворенного в
раствор
То есть;
| а также |
Поскольку K является положительным как для повышения точки кипения, так и для
депрессия точки замерзания
на повышение АД и
для понижения точки замерзания необходимо рассчитывать по-другому.
Простой способ запомнить это состоит в том, что
для депрессии замерзания — это величина точки замерзания
депрессивное (или пониженное) и
для повышения точки кипения — это величина, на которую температура кипения
повышенный (или приподнятый). Если вы помните направление, то имеете дело с
знаки легкие.
Важно отметить, что K b и K f являются
константы для данного материала, но варьируются от материала к
материал.
K f для воды 1.86
°C•кг•моль -1 ; тогда как K f для
бензол 5,12 °C•кг•моль -1 .
Точки замерзания и кипения
Поскольку точка замерзания чистой воды равна 0°C, раствор сахарозы замерзает при –0,68°C.
Аналогичным свойством растворов является повышение температуры кипения . Раствор кипит при несколько более высокой температуре, чем чистый растворитель. Изменение точки кипения рассчитывается по формуле
, где K b — молярная константа температуры кипения, а m — концентрация растворенного вещества, выраженная в моляльности.Данные о температуре кипения для некоторых растворителей приведены в таблице 1.
Обратите внимание, что изменение температуры замерзания или кипения зависит исключительно от природы растворителя , а не от идентичности растворенного вещества .
Одним из ценных применений этих соотношений является определение молекулярной массы различных растворенных веществ.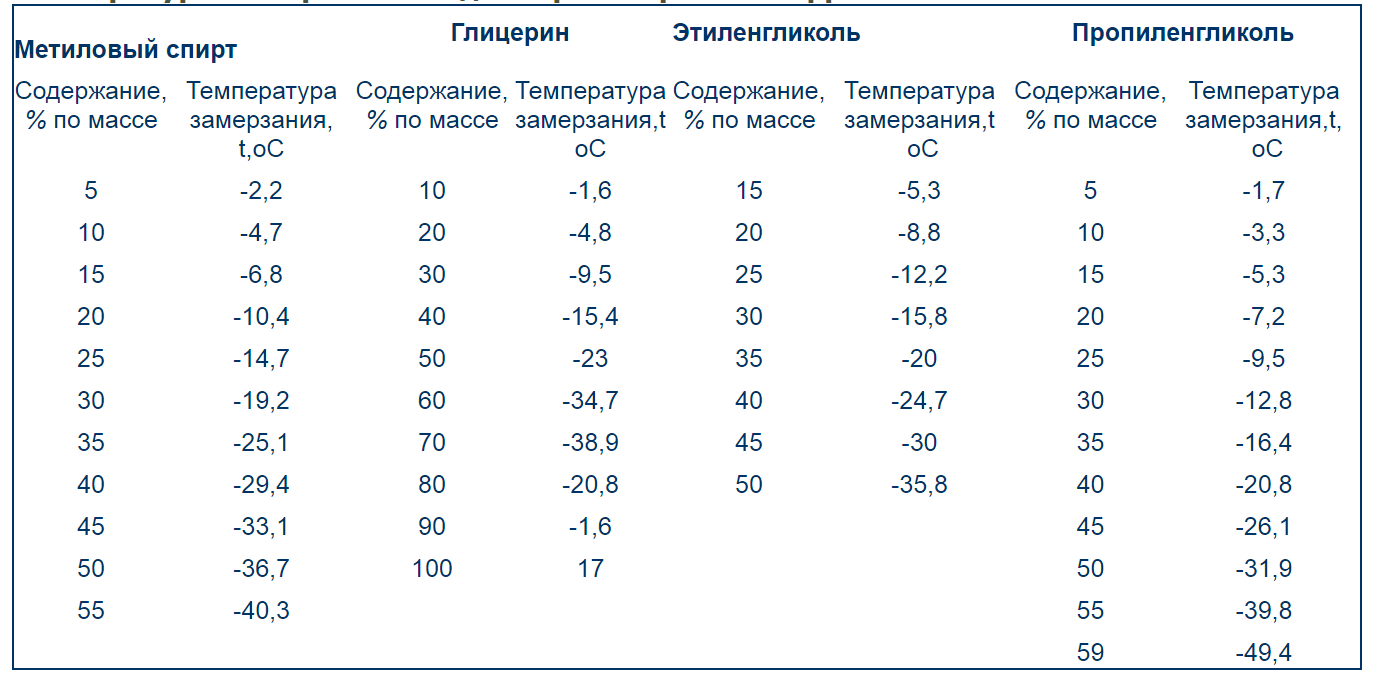 В качестве примера проведите такой расчет, чтобы найти молекулярную массу органического соединения сантоновой кислоты, растворяющегося в бензоле или хлороформе.Раствор 50 г сантоновой кислоты в 300 г бензола кипит при 81,91°С. Ссылаясь на таблицу
В качестве примера проведите такой расчет, чтобы найти молекулярную массу органического соединения сантоновой кислоты, растворяющегося в бензоле или хлороформе.Раствор 50 г сантоновой кислоты в 300 г бензола кипит при 81,91°С. Ссылаясь на таблицу
81,91°C – 80,2°C = 1,71°C = Δ T b
Преобразовав уравнение для точки кипения, чтобы получить моляльность и подставив молярную константу точки кипения из таблицы 1, вы можете получить моляльность раствора:
Эта концентрация представляет собой число молей на килограмм бензола, но в растворе использовалось всего 300 граммов растворителя.Моль сантоновой кислоты находится следующим образом:
0,3 кг × 0,676 моль/кг = 0,203 моль
, а молекулярная масса рассчитывается как
.
Температура кипения раствора использовалась для определения того, что сантоновая кислота имеет молекулярную массу приблизительно 246. Вы также можете найти это значение, используя температуру замерзания раствора.
В двух предыдущих примерах сахароза и сантоновая кислота существовали в растворе в виде молекул, а не диссоциировали на ионы.В последнем случае требуется общая моляльность всех ионных частиц. Рассчитайте общую ионную моляльность раствора 50,0 г бромида алюминия (AlBr 3 ) в 700 г воды. Потому что вес формулы AlBr 3 в граммах равен
.
26,98 + 3(79,90) = 266,68 г/моль
количество AlBr 3 в растворе
Концентрация раствора по AlBr 3 формульных единиц равна
Однако каждая формульная единица соли дает один ион Al 3+ и три иона Br – :
AlBr 3 ( s ) → Al 3+ ( водный раствор ) + 3Br – ( водный раствор )
Итак, концентрации ионов равны
Ал 3+ = 0.268 моляль
Br – = 3(0,268) = 0,804 моляль
Al 3+ + Br – = 1,072 моляль
Общая концентрация ионов в четыре раза больше, чем у соли. При расчете изменения точки замерзания или точки кипения необходимо использовать концентрацию всех частиц растворенного вещества , будь то молекулы или ионы. Концентрация ионов в этом растворе AlBr 3 составляет 1,072 моляль, и эта моляльность будет использоваться для расчета Δ T f и Δ T b .
При расчете изменения точки замерзания или точки кипения необходимо использовать концентрацию всех частиц растворенного вещества , будь то молекулы или ионы. Концентрация ионов в этом растворе AlBr 3 составляет 1,072 моляль, и эта моляльность будет использоваться для расчета Δ T f и Δ T b .
- Рассчитайте температуру кипения раствора 10 г хлорида натрия в 200 г воды.
- Раствор 100 г бруцина в 1 кг хлороформа замерзает при –64,69°С. Какова молекулярная масса бруцина?
Ответ по общей химии для Kimberli #156796
1. Что происходит при добавлении NaCl(s) в воду?
Температура кипения повышается, а температура замерзания снижается
(1) Температура кипения раствора повышается, а температура замерзания раствора снижается.
(2) Повышается температура кипения раствора и повышается температура замерзания раствора.
(3) Температура кипения раствора снижается, а температура замерзания раствора снижается.
(4) Температура кипения раствора снижается, а температура замерзания раствора повышается.
2. Объясните с точки зрения точки замерзания, какое растворенное вещество окажет большее влияние на 1000 литров воды: 1,5 моля KCl или 2 моля сахара (C6H 12O 6)
1 .5 KCl — 3 моль общих ионов
3. По сравнению с чистой водой водный раствор хлорида кальция имеет
(1) более высокую температуру кипения и более высокую температуру замерзания
(2) более высокую температуру кипения и более низкую температуру замерзания
(3) более низкая температура кипения и более высокая температура замерзания
(4) более низкая температура кипения и более низкая температура замерзания
4. При нормальном давлении при добавлении NaCl к воде раствор будет иметь
(1) более высокую температуру замерзания и более низкая температура кипения
, чем у воды
(2) более высокая температура замерзания и более высокая температура кипения, чем у воды
(3) более низкая температура замерзания и более высокая температура кипения, чем у воды
(4) более низкая температура замерзания и более низкая температура кипения, чем у воды
5.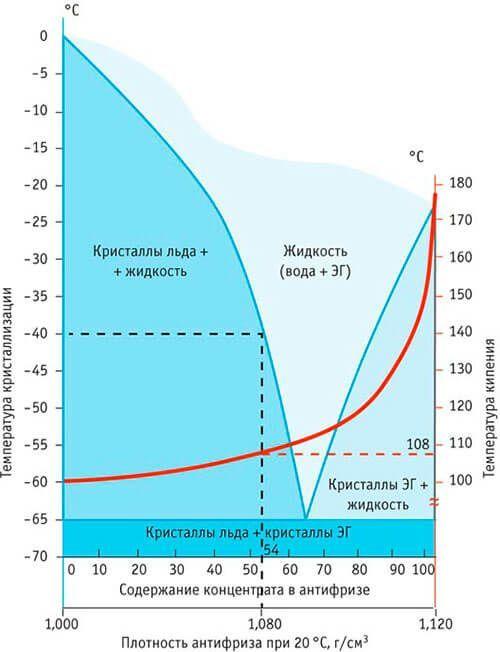 По сравнению с 1,0 М водным раствором NaCl при 1 атмосфере, 0.5 М водный раствор NaCl при 1 атмосфере имеет
По сравнению с 1,0 М водным раствором NaCl при 1 атмосфере, 0.5 М водный раствор NaCl при 1 атмосфере имеет
(1) более низкую температуру кипения и более высокую температуру замерзания
(2) более низкую температуру кипения и более низкая точка замерзания
(3) более высокая точка кипения и более высокая точка замерзания
(4) более высокая температура кипения и более низкая температура замерзания
6. Объясните, что из следующего лучше использовать во время и после метели для обеспечения безопасности улиц и тротуаров: CaCl2 или NaCl
1 моль CaCl2 — 3 моль ионов
7.По сравнению с 2,0 М водным раствором NaCl при 1 атмосфере, 3,0 М водный раствор NaCl при 1 атмосфере имеет
(1) более низкую температуру кипения и более высокую температуру замерзания
(2) более низкую температуру кипения и более низкую температуру замерзания точка
(3) более высокая температура кипения и более высокая температура замерзания
(4) более высокая температура кипения и более низкая температура замерзания
8.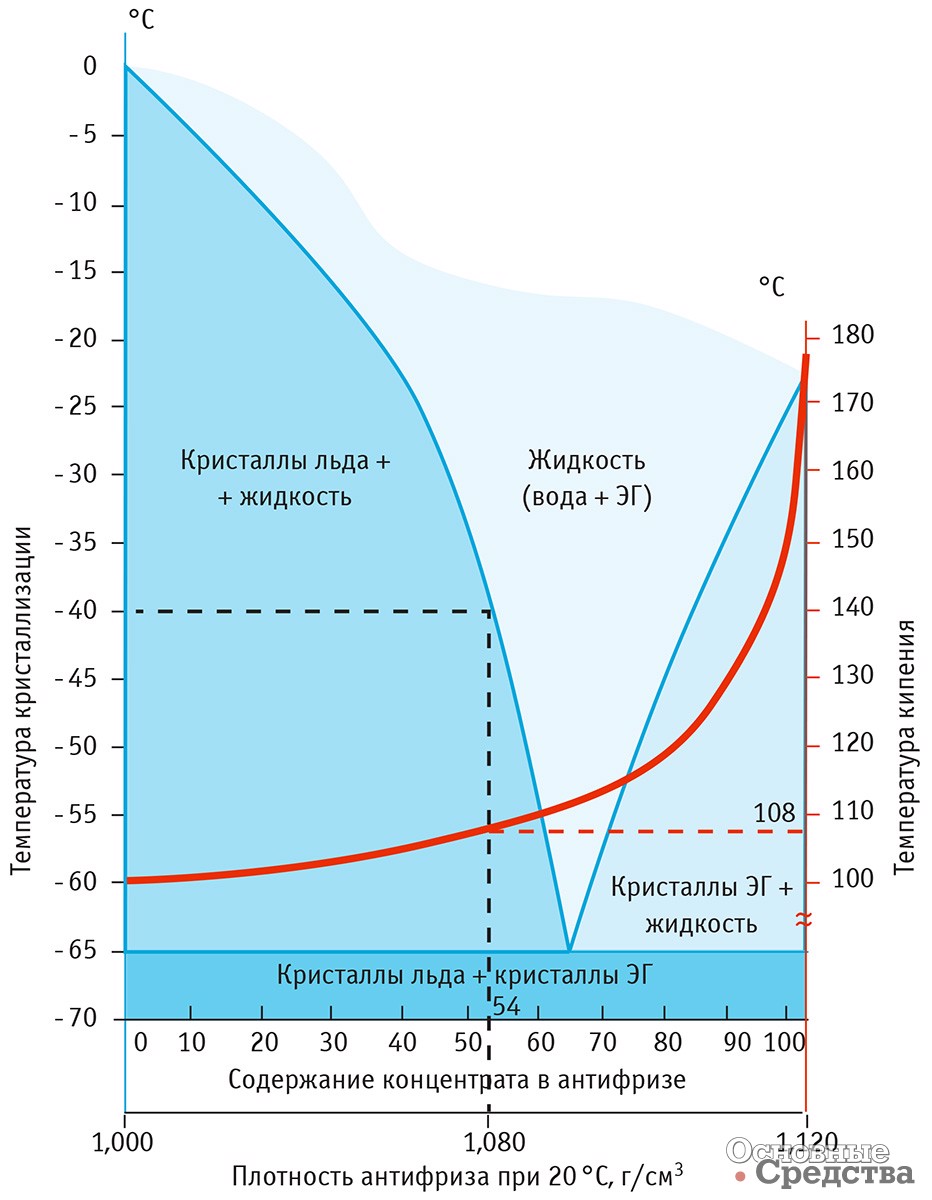 Какой водный раствор KI замерзает при самой низкой температуре?
Какой водный раствор KI замерзает при самой низкой температуре?
(1) 1 моль KI в 500 г воды
(2) 2 моль KI в 500 г.г воды
(3) 1 моль KI в 1000 г воды
(4) 2 моль KI в 1000 г воды
9. Объясните, почему Нью-Йорк посыпает солью снег после метели?
Почему вода замерзает раньше спирта?
Почему вода замерзает раньше алкоголя.
Недавно мы объяснили, что одна из причин, по которой температура замерзания вина намного ниже, чем у воды, связана с содержанием в нем спирта. Но мы не объяснили, почему спирт имеет гораздо более низкую температуру замерзания, чем вода. Давайте объясним это сейчас (подсказка: молекулы воды «более липкие».»)
Вещество замерзает, когда его молекулы «застревают» в фиксированном порядке как твердое тело. Точка замерзания этого вещества — это температура, при которой сила притяжения между его молекулами становится достаточно большой, чтобы преодолеть энергию движения, которой обладают его молекулы, когда вещество находится в жидком состоянии. Одним из факторов, влияющих на эту точку замерзания, является сила притяжения между молекулами: чем сильнее эти силы, тем выше точка замерзания. Другими словами, вещество, молекулы которого сильно притягиваются друг к другу, замерзнет при более высокой температуре, чем вещество, молекулы которого меньше притягиваются друг к другу.
Одним из факторов, влияющих на эту точку замерзания, является сила притяжения между молекулами: чем сильнее эти силы, тем выше точка замерзания. Другими словами, вещество, молекулы которого сильно притягиваются друг к другу, замерзнет при более высокой температуре, чем вещество, молекулы которого меньше притягиваются друг к другу.
Молекулы воды сильнее притягиваются друг к другу, чем молекулы этанола (спирта), потому что в воде больше атомов водорода, связанных с кислородом. Водород, связанный с кислородом, более «привлекателен», чем углерод, связанный с кислородом. Таким образом, молекулы воды «более липкие», чем молекулы этанола, поэтому молекулам воды легче «застрять» (т. е. замерзнуть)
.
Поскольку молекулы этанола не такие липкие, как молекулы воды, температура должна быть намного ниже, прежде чем силы притяжения преодолеют энергию движения и зафиксируют молекулы в их местах расположения.Вот почему спирт имеет гораздо более низкую температуру замерзания – -114,7 градусов по Цельсию (-174,6 градусов по Фаренгейту), в отличие от температуры замерзания воды 0 градусов по Цельсию (32 градуса по Фаренгейту)
.
