Расчет газосиликатных блоков: Онлайн калькулятор расчета количества газобетонных блоков
- Как правильно рассчитать количество газосиликатных блоков для постройки дома
- Калькулятор расчета строительных блоков | ООО «МирГрад»
- Расчет количества газосиликатных блоков на дом
- Как рассчитать количество газобетона для строительства гаража?
- Расчет газоблоков: формула и онлайн-калькулятор
- таблицы и прочие методы (видео)
- Структура и формула силикатов Учебное пособие по химии
- Ключевые концепции
- Пример силикатной структуры: дискретные тетраэдры
- Пример структуры силиката: одноцепочечная (пироксеновая группа силикатов)
- Пример структуры силиката: двойная цепь (амфиболовая группа силикатов)
- Пример силикатной структуры: лист
- Пример силикатной структуры: трехмерные сети (каркасы)
- Молярный объем газа Расчеты Учебное пособие по химии
- Расчеты электролиза, массы твердых частиц и объемы газов, образовавшихся на отрицательном и положительном электродах (катоде и аноде) gcse chemistry Расчеты 13. igcse KS4 science A level GCE AS A2 O Level практические вопросы упражнения
- молярный объем газа Закон Авогадро моли и массовые расчеты gcse химические расчеты igcse KS4 science A level GCE AS A2 O Level практические вопросы упражнения
- РАСЧЕТ ТЕПЛОПОТЕРЯ И РАСЧЕТ МОНТАЖА
- Расчет свойств газа — PetroWiki
Как правильно рассчитать количество газосиликатных блоков для постройки дома
От автора: здравствуйте, дорогие друзья! Одним из самых популярных вариантов для строительства домов на сегодняшний день являются газосиликатные блоки. И неудивительно, ведь этот материал обладает множеством прекрасных характеристик, делающих его использование оптимальным во многих случаях.
Если вы новичок в строительных делах, но все же решились собственноручно построить дом для себя и своей семьи, то вопрос выбора стройматериала наверняка стоит очень остро. Сегодня мы поговорим о том, насколько правильным именно для вас является применение газобетона, а также выясним, как рассчитать количество газосиликатных блоков для строительства дома.
Закупка материала — один из важнейших начальных этапов строительства. Особенно в тех случаях, когда речь идет о довольно крупных элементах. Если вы приобретете недостаточное количество, то вам придется прерывать стройку в середине процесса, тратить время на поиски товара, а также вкладывать денежные средства в доставку.
Переизбыток материала тоже не приносит положительных эмоций, так как это и лишние траты, и необходимость последующего избавления от излишков. Поэтому расчету необходимого количества элементов будущих стен нужно уделить не меньше внимания, чем выбору непосредственно стройматериала.
Характеристики газосиликата
Перед тем как производить расчет количества материала, необходимо ознакомиться с некоторыми его характеристиками. В частности, с теплопроводностью. Именно от нее зависит, какой толщины должна быть стена, и, соответственно, из какого количества рядов она будет сложена.
В случае с газосиликатными блоками дело обстоит довольно позитивно. Этот стройматериал обладает очень низким уровнем теплопроводности, поэтому однослойной стены будет вполне достаточно, чтобы в доме сохранялась комфортная температура воздуха.
Данное качество присуще газосиликату благодаря особой технологии производства. Этот материал является одной из разновидностей ячеистого бетона.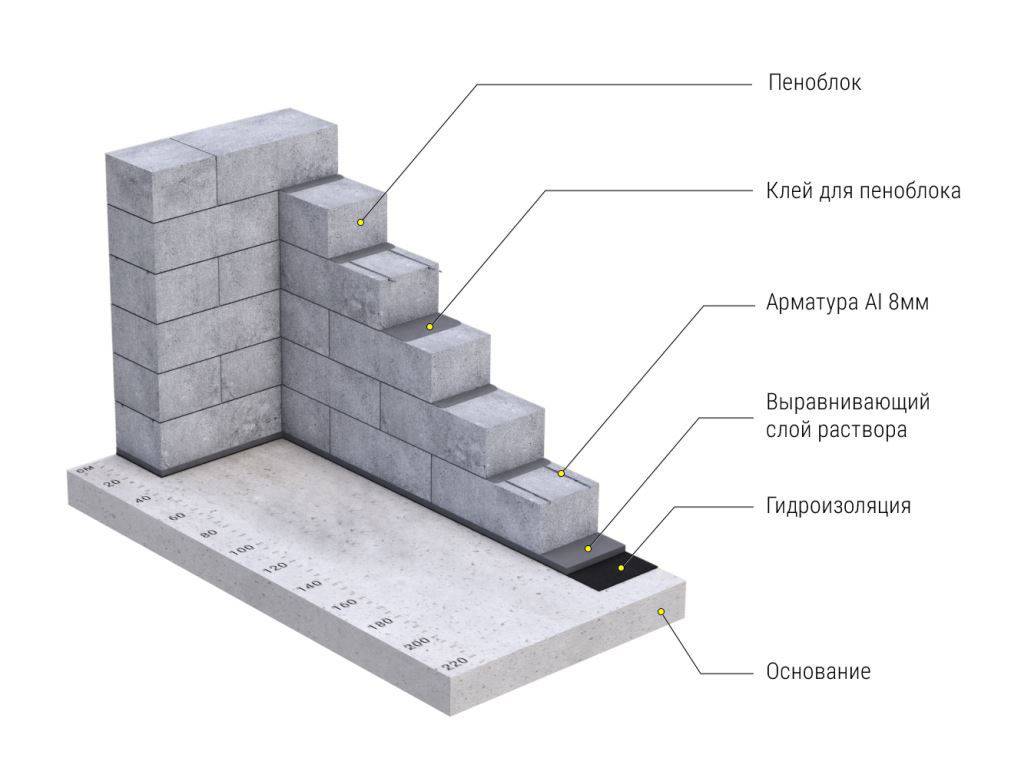 Основные ингредиенты: цемент, вода и песок. Но в процессе производства к ним добавляется еще и алюминиевый порошок, который вызывает повышенное газообразование.
Основные ингредиенты: цемент, вода и песок. Но в процессе производства к ним добавляется еще и алюминиевый порошок, который вызывает повышенное газообразование.
В результате этого структура готового газобетона очень пористая, что и позволяет материалу очень качественно задерживать тепло. Кроме того, это дает газосиликатным блокам и другие неоспоримые достоинства:
- паропроницаемость. Проще говоря, стены из газосиликата умеют «дышать». Если в жилище повышенная влажность, они впитывают излишки воды из воздуха и выводят ее на улицу. И наоборот, в случае излишней сухости воздуха в помещении стена передаст необходимое количество влаги из внешней среды внутрь. Таким образом, микроклимат в вашем доме всегда будет нормальным,
- шумоизоляция. Ячеистая структура прекрасно гасит звуковые колебания,
- легкость. Поскольку в составе блоков очень много воздуха, их вес весьма невелик, особенно в сравнении с обычным бетоном. Это позволяет сократить расходы на транспортировку, легче производить строительные работы и значительно снизить нагрузку на фундамент.

Одной из самых важных характеристик стройматериала является плотность. И вот тут возможны варианты. Выделяется три разных группы плотности. Самый низкий показатель — D400, такой газосиликат используется исключительно для теплоизоляции. то есть им обкладываются уже существующие стены, тем самым понижая их теплопроводность.
Марки от D500 до D700 более плотные. Такие блоки тоже применяют в качестве теплоизоляции, но из них можно возводить и стены. Правда, исключительно межкомнатные перегородки. Для сооружения несущих конструкций такие показатели плотности являются слишком низкими.
А вот материалы группы D700 и выше уже являются конструкционными. То есть они применяются для ответственных работ — в частности, для кладки несущих стен. Плотность этих блоков достаточно высока, поэтому они могут переносить большие нагрузки.
Помимо плотности, может варьироваться и размер элементов. Газосиликатные блоки отливаются не в отдельных формах для каждого. Сначала делается один сплошной слой массы, а после застывания ее нарезают на параллелепипеды. Габариты ограничиваются только максимальной планкой, а все, что до нее, может различаться:
Габариты ограничиваются только максимальной планкой, а все, что до нее, может различаться:
- толщина блоков варьируется от 200 до 250 миллиметров,
- высота от 100 до 500 миллиметров,
- максимальная длина — 600 миллиметров.
Данные показатели очень важны для расчета необходимого количества стройматериала для возведения стен. Давайте остановимся подробнее на том, как производятся вычисления.
Расчет количества блоков
Существует три основных метода расчета количества материала на дом: таблица, онлайн-калькулятор и ручной подсчет. В таблице собрана информация про размеры строительных элементов, а также про длину, ширину и высоту будущего здания. Ваша задача заключается в том, чтобы свести воедино необходимые конкретно для вас показатели, тогда получите искомое число.
Проблема в том, что у таблицы есть два существенных недостатка:
- размеры блоков и будущего дома, указанные в ней, стандартны. В том случае, если ваши показатели отличаются от приведенных там, расчет будет крайне неточен,
- таблица довольно сложна в использовании.
 Для ее применения необходим опыт. Этот инструмент подходит для мастеров, которые уже давно занимаются строительством. Если же вы новичок в этом деле, то вам будет немудрено запутаться и получить совершенно неверные результаты.
Для ее применения необходим опыт. Этот инструмент подходит для мастеров, которые уже давно занимаются строительством. Если же вы новичок в этом деле, то вам будет немудрено запутаться и получить совершенно неверные результаты.
Онлайн-калькулятор — более легкий способ посчитать, сколько нужно газосиликатных блоков для строительства жилища. Единственная сложность заключается в том, чтобы правильно измерить и ввести необходимые размеры:
- длину, ширину и высоту блока, который вы собираетесь использовать для строительства (в миллиметрах),
- его плотность (кг/м3),
- периметр всех стен будущего здания (в метрах),
- высоту стен, измеренную по углам (в сантиметрах),
- толщину стен, при этом единицей измерения является количество блоков: один, полтора и т. д.,
- толщина швов, то есть слоя кладочного раствора. Тут нужно учитывать, чем именно вы собираетесь скреплять элементы. Если в дело пойдет цементный раствор, то толщина каждого шва будет около сантиметра.
 А если вы решите воспользоваться специальным клеевым составом, то скрепляющие слои будут гораздо тоньше,
А если вы решите воспользоваться специальным клеевым составом, то скрепляющие слои будут гораздо тоньше, - также необходимо указать периодичность размещения кладочной сетки, если вы планируете ее применять.
Для более точного расчета желательно ввести в соответствующие графы калькулятора габариты оконных и дверных проемов: ширину и высоту каждого из них. Тогда программа автоматически вычтет те места, которые не будут заполняться газосиликатными блоками.
Можно все сделать и вручную. Например, посчитать, сколько блоков выбранного вами размера необходимо на 1 м2 кладки. Затем найдите площадь всех стен, вычтите из нее общую площадь оконных и дверных проемов. Полученный результат поделите на число блоков, помещающихся в один квадратный метр.
Конечно, воспользоваться онлайн-калькулятором гораздо проще. С другой стороны, ни одна программа не застрахована от ошибок, а в собственноручных расчетах вы можете быть абсолютно уверены, если произведете их аккуратно и внимательно. Поэтому рекомендуем потратить немного времени и сделать их самостоятельно. Успехов!
Поэтому рекомендуем потратить немного времени и сделать их самостоятельно. Успехов!
Калькулятор расчета строительных блоков | ООО «МирГрад»
Для максимальной эффективности выполнения всех работ по возведению зданий и объектов важно чётко рассчитать количество строительных материалов. Справиться с этой задачей поможет специальный онлайн-калькулятор блоков для строительства дома. С его помощью можно выполнить расчёт количества газосиликатных блоков, которые необходимо использовать для возведения построек и объектов самого разного назначения и сферы использования.
При проведении расчётов могут быть учтены некоторые дополнительные параметры, в том числе:
- проёмы для окон и дверей
- размеры фронтонов постройки
- количество строительного раствора и кладочной сетки
При выполнении расчётов с помощью онлайн-калькулятора необходимо уделять пристальное внимание при заполнении исходных данных, а также единицы измерения конечных параметров.
С какой целью используется онлайн-калькулятор расчета блоков для строительства дома
При покупке строительных материалов, особенно газосиликатных блоков, важно рассчитать их точное количество для возведения того или иного объекта. К сожалению, сделать это без специальных расчётов довольно сложно. В итоге после завершения строительства остаются лишние материалы. Онлайн-калькулятор блоков для строительства дома применяется с целью точного расчёта количества материалов предназначенных для тех или иных условий.
Где можно купить блоки газосиликатные в Бресте
Обратившись в компанию «Мирград», вы всегда сможете купить блоки газосиликатные на максимально выгодных финансовых условиях в Бресте. Рассчитать точное количество строительных материалов поможет наш онлайн-калькулятор блоков для строительства. Это поможет вам оптимизировать финансовые затраты на покупку материалов, а также завершить все работы в точно установленные сроки.
Для расчета газосиликатных блоков выберите в калькуляторе “Свои размеры блока” и введите нужные (625х300х200, 625х300х249, 625х400х249 и т. д.)
д.)
Расчет количества газосиликатных блоков на дом
Газосиликатные блоки по своим прекрасным характеристикам, таким как огнестойкость, звукоизоляция, термоизоляция, намного обгоняют стандартные кирпичи. На строительном рынке они продаются и штучно, и кубическими метрами. По сравнению с прочими подобными стройматериалами автоклавные газобетоноблоки характеризуются хорошей развитостью пористой структуры, чем и объясняются отличные параметры.
Высока прочность, отличные теплоизоляционные качества и легкий вес – основные достоинства газосиликатных блоков.
Чтобы произвести расчет нужного количества материала, можно использовать специальные калькуляторы или рассчитывать блоки из газосиликата по формулам. Сперва надо рассчитать, сколько в одном кубе помещается газосиликатных «кирпичиков».
Работы с блочным материалом и необходимые подсчеты потребуют аккуратного отношения к цифрам.
Виды газосиликатных блоков для строительства.
Чтобы провести все необходимые вычисления, нужно вооружиться такими данными, как размеры будущей постройки. Можно рассмотреть на конкретном примере. Для постройки дома выбраны блоки из газосиликата размером 20x30x60 см, объем одного равен произведению этих величин, то есть 0,036 м3.
1 м3/0,036 м3 = 27,8 штук газоблоков размером 20x30x60 см в одном кубе.
Теперь можно довольно быстро подсчитать, сколько газоблока нужно для постройки дома. Для получения результата в формулы подставляют необходимые цифры.
Способ расчета
Чтобы провести расчет и определить, сколько для строительства нужно газоблока, можно поступить так.
Клей необходимо наносить на сухую и очищенную от загрязнений поверхность блока.
- Определяется периметр всех стен дома (внутренних и внешних). Это довольно несложно сделать даже в том случае, когда конфигурация не так уж и проста. На основании плана складываются длины сторон.
- Определяется площадь всех стен: периметр умножается на высоту.

- Также нужно определить общую площадь проемов (окон и дверей).
- Площадь проемов вычитается из значения, полученного для стен. Такой расчет результатом имеет площадь стенной кладки.
- Полученный результат умножается на толщину газоблока. Получается объем газосиликатого материала, нужного для кладки, в кубических метрах.
- Объем «кирпичей» из газобетона, разделенный на количество их в кубе, дает количество газоблока, которое потребуется для выполнения кладки, в штуках.
Пример с конкретными данными
На примере определенной постройки можно рассмотреть расчет нужного количества материала. Для этого понадобится воспользоваться планом строительства с заданными параметрами. Подсчет производится без особой сложности, но необходимо внимательно относиться ко всем параметрам.
Для укладки газосиликатных блоков лучше всего использовать специальный клей.
- на плане находим размеры дома: ширину и длину. Задаем следующие параметры: 10,8 м (ширину дома) умножаем на 2, прибавляем 24 м (длину дома), также умноженную на 2, получается 69,6 м – это проектная длина элементов постройки снаружи;
- далее на плане строительства находят проектную высоту дома.
 В данном случае она равняется 2,7 м. Высота цокольного этажа 0,4 м не учитывалась в общей высоте постройки. При расчетах надо иметь это в виду;
В данном случае она равняется 2,7 м. Высота цокольного этажа 0,4 м не учитывалась в общей высоте постройки. При расчетах надо иметь это в виду; - газосиликатные блоки при возведении постройки надо укладывать так, чтобы ширина стены была равна 0,3 м. Таким образом, высота изделия из газобетона в кладке равняется 0,2 м. У взятого за образец блока из газосиликата размеры составляют 20x30x60 см;
- при кладке газобетонных стройматериалов использован раствор из цемента и песка толщиной 1,5 см на ряд;
- подсчитываем, сколько нужно уложить рядов из газобетонных материалов: 2,7 м (высота блочных стен) согласно проекту делится на 0,215 м (высота блоков). Получается 12,56 рядов. Поскольку блоки половинками укладывать не стоит, надо просто определиться, сколько именно рядов вам хочется уложить. Для данного примера можно выбрать вариант с 13 рядами газоблоков, из которых будет производиться укладка;
- показатель для стены из газосиликата без учета раствора равнялся бы 13 м*0,2 м = 2,6 м;
- при подсчетах общей наружной площади строения получаем 69,6 м*2,6 м = 180,96 м2;
- подсчитывается площадь стен за вычетом проемов дверных и оконных;
- поскольку вычисления производятся на основании готового примера, то, указав общую площадь проемов 30,3 м2 , получаем 181 м2-30 м2 = 151 кубометр – это и будет искомая общая площадь;
- сколько стройматериала понадобится на кубометр стены? Высота изделия – 0,2 м, умноженная на его длину – 0,6 м, равняется 0,12 м2; 1 м2/0,12 м2 = 8,33 «кирпичей» из газосиликата;
- сколько газобетонных «кирпичей» потребуется для кладки наружных стен при том, что надо учитывать и проемы? Считаем: площадь стен – 151 м2 * 8,33 шт.
 = 1258 кубометров;
= 1258 кубометров; - внутренние перегородки планировалось укладывать, принимая во внимание, что ширина газосиликатного «кирпичика» для кладки – 0,2 м, высота – 0,3 м. Аналогично подсчитывается, сколько материала потребуется для внутренних перегородок: площадь будет равняться 48 кубометров;
- подсчет количества блоков, которое потребуется для внутренних перегородок на 1 м2 кладки: 0,3 м умножается на 0,6 м. Получается 0,18 кубометра. Затем 1 м2/0,18 м2 = 5,56 штук;
- 48 м2 * 5,56 шт. = 267 штук понадобится для внутренних конструкций;
- завершающий расчет: 1258 м2 + 267 шт. = 1525 штук газобетонных блоков понадобится для работ;
- 1525/27,7 = 55,05 или 55 кубометров газосиликатных «кирпичей» потребуется для строительства при данном проекте.
Можно воспользоваться приведенным примером для вычисления количества газосиликатных блоков, подставляя взамен свои данные. Существуют и другие способы для вычисления количества материала для газобетонных построек. Также возможен расчет компонентов, используемых в создании газобетона. Он пригодится при самостоятельном замешивании раствора. Здесь, помимо величины и объема, потребуется такой показатель, как масса вещества.
Существуют и другие способы для вычисления количества материала для газобетонных построек. Также возможен расчет компонентов, используемых в создании газобетона. Он пригодится при самостоятельном замешивании раствора. Здесь, помимо величины и объема, потребуется такой показатель, как масса вещества.
Как рассчитать количество газобетона для строительства гаража?
Газобетон сегодня на пике популярности не только благодаря своим теплоизоляционным свойствам, но в большой степени из-за ценовой доступности материала. В целях экономии, из ячеистого бетона часто возводят постройки, не предназначенные для проживания людей – хозблоки, гаражи, даже бани. Как рассчитать требуемое количество газоблоков, чтобы хватило на строительство, но не было остатков?
Строго говоря, расчет ведется по одной и той же схеме для любых объектов. Но мы возьмём для примера строительство гаража, чтобы научиться делать расчет газобетона на простых формах.
Необходимое число стенового газобетона вычисляют одним из двух способов:
- В кубических метрах;
- В штуках.

Выбор единицы расчёта зависит от вариантов отгрузки у продавца. Если покупается газобетон поштучно, считаем в штуках, а если в кубометрах – берем за основу единицы объёма. Чаще всего магазины строительных материалов стоимость газобетона рассчитывают за метр кубический, а продают упаковками (поддонами), которые формируются на предприятиях производителей и различаются по объёму, поскольку упаковочное оборудование и тара у всех разные.
Итак, гараж.
Расчёт газобетона в кубометрах.
Чтобы узнать требуемое количество газобетонных блоков, необходимо вычислить объём будущей конструкции, перемножив длину, ширину, высоту и расчетную толщину стен. Например, наш гараж рассчитан на одну машину и небольшой стенд для авто принадлежностей. Длина его будет 4 метра, ширина — 3, высота – тоже 3, а толщина стен небольшая – 0,2 метра. Ворота в гараж, допустим, будут 2,2 х 2,2 м. Окна в гараже ни к чему, так что не станем закладывать на них вычет материала.
Считаем периметр стен: 3 х 4 = 12 метров. Затем умножаем его на высоту и получаем общий объём гаража 36 м3. Корректировка на ширину стены даст представление об объёме только самих стен. В нашем случае, 36 х 0,2 = 7,2 м3.
Затем умножаем его на высоту и получаем общий объём гаража 36 м3. Корректировка на ширину стены даст представление об объёме только самих стен. В нашем случае, 36 х 0,2 = 7,2 м3.
Сходным образом считается и объём дверного проёма (ворот) гаража, а затем эту величину необходимо вычесть из общего количества:
- 2,2 х 2,2 х 0,2 = 0,97 м3
- 7,2 – 0,97 = 6,23 кубометра газобетона потребуется на строительство гаража из нашего примера.
- Наконец, узнаем в магазине кубатуру выбранного газоблока в поддоне, и делим на данное значение нужный нам объём для гаража. Например, в одном поддоне 1,68 м3 газобетона.
- 6,23 / 1,68 = 3,7 поддона нужно, будем покупать 4 ровно.
Производители рекомендуют приобретать газоблоки с небольшим запасом. Вот и пусть «лишние» 0,3 куба останутся про запас.
По данному алгоритму можно рассчитать газобетон для любых построек. В случае сложной конфигурации, вычисляют требуемый объём для каждой стены, затем значения суммируются.
Поштучный расчет газобетона.
Вряд ли это математическое действо пригодится, если Вы предпочитаете подтверждённое качество строительных материалов и не покупаете их у кустарей. И, тем не менее, при расчёте числа газоблоков в штуках, дополнительно высчитывают объём одного блока в кубических метрах, а затем находят отношение общего объёма стен к объёму одного блока.
Например, газоблок габаритами 200*250*600 мм имеет кубатуру 0,03 метра.
6,23 / 0,03 = 207 штук газобетонных блоков нужно для строительства нашего гаража.
Расчет газоблоков: формула и онлайн-калькулятор
На чтение 6 мин. Просмотров 1.1k. Обновлено
Газоблоки можно назвать самым распространенным строительным материалом на сегодняшний день. Он используется при возведении стен, колон, несущих и перегородочных конструкций, обладает высокими эксплуатационными качествами, и при всем этом имеет относительно небольшую стоимость.
Для того чтобы строительные работы проходили без задержек, а по их окончанию не оказалось много лишнего строительного материала, что говорит о нецелесообразной трате средств, следует проводить расчет газоблока. Это делается при использовании самых различных формул и специальных программ.
Для чего необходимо производить расчет газоблоков?
При создании проекта дома или другого сооружения достаточно важно указать количество блоков или их общий объем, необходимый для проведения строительных работ.
Это связано со следующими моментами:
- Рассчитывается стоимость всего проекта. Для того чтобы планировать бюджет на проведение работ по строительству следует знать то, какова конечная стоимость проекта. Сначала проводится выбор материала и расчет его необходимого количества, после чего уточняется цена. Результатам станет приблизительный размер предстоящих затрат, касающихся материалов.
- При одновременном приобретении всего необходимого объема материала можно сэкономить на его доставке.
 Несмотря на то, что газоблоки имеют меньший вес, чем стандартный кирпич, большой его объем можно перевезти только при заказе грузового автомобиля. Если окажется, что нужно было больше материала, то придется снова заказывать транспорт.
Несмотря на то, что газоблоки имеют меньший вес, чем стандартный кирпич, большой его объем можно перевезти только при заказе грузового автомобиля. Если окажется, что нужно было больше материала, то придется снова заказывать транспорт. - При оптовой покупке некоторые продавцы предоставляют скидку.
Кроме этого на момент возведения коробки, несущих конструкций многие строители стараются избежать ситуации, когда работа останавливается до ее полного завершения.
К примеру, незавершенная работа по возведению стен станет причиной оказания серьезного воздействия на блоки и клеящий состав по причине выпадения осадков.
Также не стоит забывать о том, что некоторые строители, которые были наняты на работу, берут плату за неустойку, когда им приходится тратить рабочее время в пустую по причине отсутствия необходимого строительного материала.
Как произвести расчет?
Для проведения наиболее точных расчетов требуется довольно много входных данных. Для начала уделим внимание возможности использования формул и онлайн калькуляторов.
Для начала уделим внимание возможности использования формул и онлайн калькуляторов.
Оба варианты проводят расчет на основании выведенных зависимостей и математических формул, но в первом случае придется делать вычисления самостоятельно, в другом достаточно только ввести требуемые данные.
Формулы расчетов
Формулы вычисления необходимого количества блоков для проведения строительных работ:
L * Н — Sпр) * 1,05 * В = V,
Где:
- L–длина стен, которые будут возводиться при использовании рассчитываемого материала.
- H – высота стен, в данном случае берется средний показатель, что определяет погрешность.
- Sпр – площадь оконных и дверных проемов, измеряется в кв.м.
- 05 – коэффициент, который был принят с учетом проведения работы по подрезке блоков.
- B – толщина создаваемой стены.
Полученный результат определяет то, какой объем материала потребуется для выполнения работы. Если кладка будет проводиться в один ряд, то можно выбросить из формулы значение B, что позволит получить показатель в квадратных метрах.
Если кладка будет проводиться в один ряд, то можно выбросить из формулы значение B, что позволит получить показатель в квадратных метрах.
Для расчета количества блоков при вычислении требуемого объема следует провести деление полученного результата на объем одного блока, если был получен показатель площади, то на площадь фронтальной поверхности.
Рассчитать параметры блока достаточно просто, так как практически все производители указывают его габаритные размеры.
Онлайн-калькулятор
Существенно упростить свои расчеты можно при использовании онлайн-калькулятора, к примеру, http://stroy-calc.ru/raschet-gazoblokov. Его точность расчетов очень высока, при этом достаточно ввести только требуемую информацию.
Его точность расчетов очень высока, при этом достаточно ввести только требуемую информацию.
К особенностям использования этого калькулятора отнесем следующие моменты:
- Требуется провести ввод габаритных размеров блока, который планируется использовать при строительстве. При открытии страницы эти значения уже заполнены параметрами наиболее распространенного газоблока.Стоит учитывать, что линейные параметры указываются в миллиметрах. Если размеры измерялись в сантиметрах, то следует провести умножение полученного результата на 10.
- Также есть поле, в котором следует ввести показатель плотности. Этот параметр можно оставить без изменений, если он не известен. Плотность вводится для расчета оказываемой нагрузки на фундамент и общего веса всех необходимых блоков – последний параметр понадобится при выборе транспорта, на котором будет осуществляться доставка.
- Указывается параметр периметра, высоты и толщины стен. При это высота учитывается по углам.

- Можно ввести и толщину раствора, который будет использоваться при кладке.
- Если нужно посчитать конечную стоимость, то указывается и цена за один квадратный метр материала.
Также есть и дополнительные параметры, которые открываются при установке галочки на пунктах «Фронтоны», «Учесть окна и двери». Фронтон отличается тем, что зачастую имеет сплошную кладку с клиновидным возвышением, то есть количество используемого строительного материала увеличивается.
В открывшейся вкладке фронтонов указывается их количество, показатель ширины и высоты. Считается, что толщина фронтона такая же, как и остальных стен.
Частой ошибкой можно назвать то, что при расчетах не учитываются окна и двери. Рассматриваемый калькулятор позволяет ввести размеры окон и дверей для вычисления их площади, а также количества этих элементов.
Какие сведения можно получить по результатам расчетов?
При использовании обычной формулы можно получить только приближенный результат того, сколько нужно будет блоков. Поэтому в последнее время подобны образом проводят расчеты крайне редко.
Поэтому в последнее время подобны образом проводят расчеты крайне редко.
Рассматриваемый в данной статье калькулятор позволяет получить большее количество показателей, также есть ссылки на другие программы, позволяющие рассчитать нужное количество утеплителя.
Основные результаты по расчетам этого калькулятора:
- Периметр строения и общая площадь кладки.
- Количество блоков, их вес и объем.Стоимость строительного материала.
- Необходимое количество раствора.
- Количество рядов.
- Примерный вес стены и оказываемое давление на основание.
Вышеприведенный список определяет то, что онлайн-калькулятор позволяет получить информацию, которая используется и при многих других расчетах, к примеру, при выборе типа фундамента и величины его заземления.
Советы строителей по расчетам газоблоков
Распространенными советами по рассматриваемому вопросу можно назвать:
- Необходимость использования калькулятора.

- Введение всей требующейся информации.
- Использование проекта будущего сооружения в качестве источника основной информации.
- Указание наличие окон и дверей, их размеры.
Современные программы существенно упрощают проведения работы по вычислениям различных параметров.
В заключение отметим, что онлайн-калькуляторы находятся в свободном доступе. Именно поэтому следует их обязательно использовать при проектировании сооружения, так как это принесет лишь пользу.
таблицы и прочие методы (видео)
Давно прошло время, когда застройщик мог позволить себе покупать материалы, предварительно не производя расчета количества газосиликатных блоков. Закупка в те времена практически всегда проводилась на глаз. В настоящее время перед тем, как построить дом, любой человек проведет тщательный расчет кирпичей или блоков, которые необходимы ему для строительства.Только на первый взгляд кажется совсем простой процедурой рассчитать правильно количество, например, газосиликатных блоков для определенного строения. Если вы собираетесь строить дом по архитектурному проекту, то надобности что-либо считать нет, так как эту процедуру проделали опытные архитекторы еще на этапе планирования. Совсем другое дело, если строительство будет вестись по собственной задумке.
Закупка в те времена практически всегда проводилась на глаз. В настоящее время перед тем, как построить дом, любой человек проведет тщательный расчет кирпичей или блоков, которые необходимы ему для строительства.Только на первый взгляд кажется совсем простой процедурой рассчитать правильно количество, например, газосиликатных блоков для определенного строения. Если вы собираетесь строить дом по архитектурному проекту, то надобности что-либо считать нет, так как эту процедуру проделали опытные архитекторы еще на этапе планирования. Совсем другое дело, если строительство будет вестись по собственной задумке.
Таблица характеристик газосиликатных блоков.
Доступные способы вычислений
Расчет количества газосиликатных блоков можно произвести разными способами:
- с помощью специальных таблиц;
- с помощью электронного калькулятора, специальной строительной программы;
- самостоятельно, посредством определенных измерений и вычислений.
Вернуться к оглавлению
Таблица или электронный калькулятор?
Таблица размеров газосиликатных блоков.
Таблицы более подходят для опытного строителя. В них уже учтены размеры газосиликатных блоков и линейные параметры будущего строения (длина, ширина и высота). Достаточно только правильно сопоставить все компоненты, и вы получите приблизительное количество единиц, которые вам необходимо приобрести. Такой способ расчета для обычного человека не подходит по нескольким причинам: пользоваться таблицами так же сложно, как и логарифмической линейкой, а результат будет приблизительным, поскольку размеры окон и дверных проемов учтены только для стандартных строений.
Калькуляторы количества материалов, которые присутствуют на страницах сайтов торговых организаций, дают ненамного большую точность, хотя программой дополнительно запрашивается масса параметров строения.
Вернуться к оглавлению
Собственноручные вычисления
Куда надежнее рассчитать количество необходимых стройматериалов с помощью математики. Итак, для этой процедуры потребуются:
- рулетка;
- знания о понятии объема.

Преимущества стен из газосиликатных блоков.
Газосиликатные блоки выпускаются с различными линейными параметрами, поэтому рассмотрим общую методику расчета их количества по объему в кубических метрах.
Сначала необходимо узнать длину и ширину строения по внешнему периметру. Умножаем оба параметра и получаем площадь, которую будет занимать строение с внешней стороны. Эту же процедуру необходимо проделать и для внутренней части строения. А теперь определяем разность между полученными площадями. Это и будет площадью опоры вашего строения. Далее необходимо умножить полученную разность на предполагаемую высоту строения.
В результате выполненных действий вы получите объем стен, соответственно, и объем, который будут занимать газосиликатные блоки. Нужно отметить, что вы рассчитали полный объем стен, без наличия в них проемов для окон и дверей. Значит, еще следует отнять от общего результата объемы всех необходимых проемов. Делается это просто: умножаем три параметра (длину и ширину проема, а также предполагаемую толщину стен) и получаем точный результат. А теперь от полученного ранее общего объема отнимите соответствующие объемы всех проемов, и вы получите чистый объем строения.
А теперь от полученного ранее общего объема отнимите соответствующие объемы всех проемов, и вы получите чистый объем строения.
Вернуться к оглавлению
Еще один простой метод
Загляните в прайс-лист компании, которая будет организовывать вам поставку. Там должны быть указаны все измерения газосиликатных блоков. Определите объем одного и разделите на него ранее полученный чистый результат. Количество единиц вы рассчитаете с точностью до одной штуки. Но это лишь с той оговоркой, что ширина толщина стены будет кратна одному из линейных параметров материала.
Стоит ли закупать для строительства расчетное количество материала? Нет. Обычно при строительстве блоки приходится подрезать, подгонять их под определенный размер. Это значит, что определенное количество (около 5%) должно быть сверх нормы. Вторая причина, вынуждающая приобретать большее количество материала, заключается в его качестве и возможной порче изделий при транспортировке и погрузочно-разгрузочных работах.
С целью уменьшения количества стройматериалов рекомендуется продумать планировку будущего строения с учетом размеров самих блоков.
Параметры дома должны точно сочетаться с линейными размерами газосиликатных блоков. Проще говоря, длина строения должна быть кратна длине блока. Точно так же определяется кратность и ширины строения. Выиграете вы не только в плане количества материалов, но и в удобстве кладки стен, так как придется минимальное количество раз подрезать блоки. Если такие расчеты кажутся вам слишком сложными, то за помощью можно обратиться в любую строительную организацию. Для опытного строителя не составит труда сделать необходимы расчеты.
Структура и формула силикатов Учебное пособие по химии
Ключевые концепции
Пожалуйста, не блокируйте рекламу на этом сайте.
Без рекламы = для нас нет денег = для вас нет бесплатных вещей!
Пример силикатной структуры: дискретные тетраэдры
Минерал оливин существует в виде дискретных тетраэдров SiO 4 4- с зарядом, уравновешенным ионами магния.
Мы можем определить формулу оливина, уравновесив заряды на ионах:
- заряд оливина = заряд силикат-аниона + заряд катионов
Суммарный заряд оливина = 0
формула дискретного силикатного тетраэдра: SiO 4 4-
заряд на SiO 4 4- = -4
заряд на Mg 2+ = +2 - Пусть n будет количеством Mg 2+ , необходимым для уравновешивания заряда силикат-иона:
0 = -4 + ( п × +2)
+4 = 2 n
n = 2 - для оливина: Mg 2 SiO 4
Формула
Пример структуры силиката: одноцепочечная (пироксеновая группа силикатов)
Минерал энстатит состоит из длинных одиночных цепочек силикатных анионов, заряд которых уравновешивается ионами магния.
Электростатическое притяжение между катионами магния и силикатными анионами удерживает вместе плотно упакованные цепи.
Мы можем определить формулу энстатита, уравновесив заряды на ионах:
- заряд энстатита = заряд силикат-аниона + заряд катионов
Общий заряд энстатита = 0
Формула
для силикатных анионов в длинных одиночных цепочках: SiO 3 2-
заряд силикатных анионов в длинных одиночных цепочках = -2
заряд на Mg 2+ = +2 - Пусть n будет количеством Mg 2+ , необходимым для уравновешивания заряда силикат-иона:
0 = -2 + ( п × +2)
+2 = 2 n
n = 1 - для энстатита: MgSiO 3
Формула
Пример структуры силиката: двойная цепь (амфиболовая группа силикатов)
Минерал купфферит представляет собой силикат с двойной цепью и имеет формулу Mg 7 Si 8 O 22 (OH) 2 .
Повторяющейся единицей в купферите является ион Si 4 O 11 6-, однако, чтобы избежать доли катионов магния в формуле, формула силикатного аниона удваивается до Si 8 O 22 12- .
Ионы гидроксида, OH — , присутствующие в структуре, не связаны с атомами Si в структурном каркасе, они координируются вокруг катионов магния.
Мы можем проверить, что минерал купфферит не имеет полного заряда:
заряд купферита = (7 × 2+) + (8 × 4+) + (22 × 1-) + (2 × 2-) = 14 + 32-44-2 = 0
Пример силикатной структуры: лист
Минеральный тальк состоит из «сэндвича» из двух листов тетраэдров с основаниями, образующими внешнюю сторону сэндвича, как показано на диаграмме справа.
Два слоя листов прочно связаны вместе с помощью Mg 2+ , согласованного с двумя атомами кислорода от каждого листа (и двумя OH — ).
Слои «сэндвича» слабо связаны только слабыми силами Ван-дер-Ваальса, что позволяет слоям сэндвича легко скользить друг по другу.
Тальк — самый мягкий из известных минералов, он очень рассыпчатый, поэтому его можно использовать в качестве смазки.
Формула талька: Mg 3 Si 4 O 10 (OH) 2 .
Повторяющаяся единица силикатного аниона в структуре — Si 2 O 5 2- , но для того, чтобы избежать доли катионов магния в формуле, формула силикатного аниона удваивается до Si 4 O 10 4-.
Пример силикатной структуры: трехмерные сети (каркасы)
В кремнеземе SiO 2 каждый атом Si ковалентно связан с 4 атомами O, и каждый атом O ковалентно связан с двумя атомами Si, образуя трехмерную сетку.
Общий заряд кремнезема равен 0, так как степень окисления кремния (+4) уравновешивается двумя атомами кислорода со степенями окисления -2 каждый (2 × -2 = -4).
Для балансировки заряда катионы не требуются.
Молярный объем газа Расчеты Учебное пособие по химии
Пожалуйста, не блокируйте рекламу на этом сайте.
Без рекламы = для нас нет денег = для вас нет бесплатных вещей!
Молярный объем газа (V м ) Concept
Молярный объем идеального газа, V м , равен , определяемому как как объем 1 моля идеального газа при заданной температуре и давлении.
Молярный объем газа, V м , следовательно, представляет собой объем газа на моль газа, поэтому единицами молярного объема газа являются:
единицы объема / моль
или
единицы объема ÷ моль
Метрическая единица измерения (4) для объема — литр, л, поэтому молярный объем газа — это объем в л / моль.
| V м дюйм л моль -1 | = | объем газа в литрах 1 моль газа | (при указанной температуре и давлении) |
Мы можем использовать это соотношение для молярного объема идеального газа (V м ), чтобы написать уравнение для объема (V в литрах) любого количества газа (n в молях).
| V м дюйм л моль -1 | = | объем газа в литрах количество газа в молях | (при указанной температуре и давлении) |
| V м дюйм л моль -1 | = | V (л) n (моль) | (при указанной температуре и давлении) |
Чтобы использовать это соотношение, нам нужно знать V m .
Ниже приводится список некоторых способов описания условий, при которых V м составляет 22,71 л.
V м = 22,71 л моль -1 при 0 ° C и 100 кПа
V м = 22,71 л моль -1 при 273,15 К и 100 кПа
V м = 22,71 л моль -1 при стандартных температуре и давлении
В м = 22,71 л моль -1 на СТП
Когда V м = 22.71 л моль -1 соотношение между объемом газа V (л) и количеством газа n (моль) становится следующим:
| V m дюйм л моль -1 | = | V (л) n (моль) | (на СТП) | |
| 22,71 л моль -1 | = | V (л) n (моль) | (на СТП) |
Это математическое уравнение можно изменить, чтобы найти объем известного количества газа, умножив обе части уравнения на количество газа в молях, n (моль),
| n ( | = | В (л) × | (на СТП) | |
| n × 22,71 | = | V (л) | (на СТП) |
Это соотношение показывает нам, что если мы увеличим количество молей газа n, добавив больше газа при сохранении той же температуры и давления, объем газа V также увеличится.
Аналогичным образом, если мы уменьшим количество молей газа n, удалив часть газа при сохранении той же температуры и давления, объем газа V также уменьшится.
Математическое уравнение, приведенное выше, можно изменить, чтобы найти количество газа в молях с учетом его объема в литрах, разделив обе части уравнения на молярный объем газа (22,71 л моль -1 при STP),
| н (моль) × | = | V ( 22,71 ( | (на СТП) | ||
| н (моль) | = | В 22,71 | (на СТП) | ||
Это соотношение показывает нам, что единственный способ увеличить объем газа V при сохранении той же температуры и давления — это увеличить количество присутствующих молей газа n, то есть добавить больше газа.
Аналогичным образом, единственный способ уменьшить объем газа V при сохранении той же температуры и давления — это уменьшить количество присутствующих молей газа n, то есть удалить часть газа.
Решение проблем с использованием молярного объема газа
Проблема: Химик Крис работает в лаборатории, в которой поддерживается постоянная температура 25 ° C и постоянное давление 100 кПа.
Крису нужно проанализировать немного карбоната кальция, CaCO 3 (s), чтобы определить, является ли он чистым или загрязненным.Крис проанализирует карбонат кальция, взяв небольшой образец размером 0,00500 моль и добавив к нему соляную кислоту HCl (водн.), Пока весь карбонат кальция не исчезнет и не перестанет образовываться углекислый газ CO 2 (г).
По мере добычи газ будет собираться методом вытеснения воды.
Известно расчётное химическое уравнение этой реакции:
CaCO 3 (т.) + 2HCl (водн.) → CaCl 2 (водн.) + CO 2 (г) + H 2 O (л)
Если образец чистый, какой объем углекислого газа будет собран?
Решение проблемы с использованием модели StoPGoPS для решения проблем:
| СТОП! | Сформулируйте вопрос. | Что вас просят сделать? Определите объем углекислого газа, если карбонат кальция чистый. В (CO 2 (г) ) = объем газообразного диоксида углерода =? L |
| ПАУЗА! | План. | Какой химический принцип вам нужно будет применить? Применить стехометрию (V (g) = n (g) × V m ) Какую информацию (данные) вам предоставили? Какие шаги нужно предпринять для решения проблемы? Шаг 1: Вычислить количество молей углекислого газа, CO 2 (г), произведено Предположим, что CaCO 3 имеет 100% чистоту (без примесей). Используйте вычисленное химическое уравнение для определения количества молей CO 2 произведенного
Шаг 2: Рассчитайте объем CO 2 (г) Предположим, что потери CO нет. 2 (г), то есть весь добытый газ собирается.
|
| Вперед! | Следуйте плану. | Шаг 1: Вычислить количество молей углекислого газа, CO 2 (г), произведено Предположим, что CaCO 3 имеет 100% чистоту (без примесей). Используйте вычисленное химическое уравнение для определения количества молей CO 2 произведенного
Шаг 2: Рассчитайте объем CO 2 (г) Предположим, что потери CO нет. 2 (г), то есть весь добытый газ собирается.
|
| ПАУЗА! | Поразмышляйте над правдоподобием. | Вы ответили на заданный вопрос? Да, мы определили объем собираемого углекислого газа. Разумно ли ваше решение вопроса?
Мы достаточно уверены, что наше решение проблемы верное. |
| СТОП! | Назовите решение. | Какой объем углекислого газа будет собран, если проба представляет собой чистый карбонат кальция? В (CO 2 (г) ) = 0.124 л при 25 ° C и 100 кПа. |
Расчеты электролиза, массы твердых частиц и объемы газов, образовавшихся на отрицательном и положительном электродах (катоде и аноде) gcse chemistry Расчеты 13. igcse KS4 science A level GCE AS A2 O Level практические вопросы упражнения
Объяснение электролиза НАЧАЛО СТРАНИЦЫ
Часть первая:
Тесты для самооценки по электролизу введите ответ Викторина или ВИКТОРИНА
Больше математики для
Объяснение электролиза Тесты для самооценки по электролизу введите ответ Викторина или большой выбор ВИКТОРИНА НАЧАЛО СТРАНИЦЫ Выше представлена типичная таблица Менделеева, используемая в спецификациях по науке и химии GCSE в и я «обычно» использовал эти значения в своих расчетах на примере, чтобы охватить большинство ДРУГИЕ РАСЧЕТНЫЕ СТРАНИЦЫ
НАЧАЛО СТРАНИЦЫ количественный электролиз | ||||||||||||||||||||||||||||||
молярный объем газа Закон Авогадро моли и массовые расчеты gcse химические расчеты igcse KS4 science A level GCE AS A2 O Level практические вопросы упражнения
НАЧАЛО СТРАНИЦЫ Продвинутый Объем реагирующего газа Выше представлена типичная таблица Менделеева, используемая в спецификациях по науке и химии GCSE в и я «обычно» использовал эти значения в своих расчетах на примере, чтобы охватить большинство НАЧАЛО СТРАНИЦЫ ДРУГИЕ РАСЧЕТНЫЕ СТРАНИЦЫ
Расчет молярного объема газа НАЧАЛО СТРАНИЦЫ |
РАСЧЕТ ТЕПЛОПОТЕРЯ И РАСЧЕТ МОНТАЖА
РАСЧЕТ ТЕПЛОВЫХ ПОТЕРЯХ И РАСЧЕТЫ ПРИ МОНТАЖЕ
ПРИБЛИЗИТЕЛЬНЫЙ РАСЧЕТ ТЕПЛОВЫХ ПОТЕР И ВЫБОР КОМПОНЕНТОВ СИСТЕМЫ
РАСЧЕТ ТЕПЛОПОТЕРЯ:
Инженерно:
С помощью этого метода лист расчета потерь тепла, лист радиатора и подробный расчет, лист расчета значений потерь и лист расчета труб заполняются отдельно для каждой среды во время расчета потерь тепла.
В таблице расчета теплопотерь расчеты производятся с учетом направления объема, для которого производится расчет теплопотерь, толщины стены-перекрытия и площади внешних стен-полов-окон. Лист радиатора и подробный расчет используется при выборе радиаторов и размещении на архитектурном проекте после расчета объемных тепловых потерь. В таблице значений потерь (удельного сопротивления) указаны потери, которые затрудняют прохождение воды в трубах, S-образных частях, скобах, разделениях и т. Д., и вызвать потерю давления. В таблице расчета труб каждая часть трубы в системе пронумерована, и лист заполняется такими параметрами, как количество тепла, проходящего через каждую часть, длину, скорость и коэффициент трения.
Примерный метод:
Обогреваемые объемы имеют приблизительные расчетные значения 3 м в единицах среднегодовых температур.
Для 3 o C:
Изоляция защищенная Ккал / чм 3 | Утепленный свободный Ккал / чм 3 | Неизолированный защищенный Ккал / чм 3 | Без утепления бесплатно Ккал / чм 3 | |
Пентхаус | 19 | 28 | 30 | 40 |
Мезонин | 17 | 25 | 26 | 35 |
Подвал | 19 | 28 | 30 | 40 |
Для -3 o C:
Изоляция защищенная Ккал / чм 3 | Утепленный свободный Ккал / чм 3 | Неизолированный защищенный Ккал / чм 3 | Без утепления бесплатно Ккал / чм 3 | |
Пентхаус | 22 | 30 | 40 | 50 |
Мезонин | 20 | 28 | 32 | 40 |
Подвал | 22 | 30 | 35 | 45 |
Для -6 o C:
Изоляция защищенная Ккал / чм 3 | Утепленный свободный Ккал / чм 3 | Неизолированный защищенный Ккал / чм 3 | Без утепления бесплатно Ккал / чм 3 | |
Пентхаус | 25 | 33 | 45 | 55 |
Мезонин | 22 | 30 | 35 | 43 |
Подвал | 25 | 33 | 40 | 50 |
Для -12 o C:
Изоляция защищенная Ккал / чм 3 | Утепленный свободный Ккал / чм 3 | Неизолированный защищенный Ккал / чм 3 | Без утепления бесплатно Ккал / чм 3 | |
Пентхаус | 28 | 38 | 50 | 60 |
Мезонин | 24 | 34 | 38 | 46 |
Подвал | 28 | 38 | 44 | 54 |
Для -21 o C:
Изоляция защищенная Ккал / чм 3 | Утепленный свободный Ккал / чм 3 | Неизолированный защищенный Ккал / чм 3 | Без утепления бесплатно Ккал / чм 3 | |
Пентхаус | 35 | 45 | 60 | 70 |
Мезонин | 30 | 40 | 44 | 55 |
Подвал | 35 | 45 | 53 | 63 |
Приблизительные потери тепла желаемого объема можно рассчитать с помощью этих таблиц.Котел выбирается исходя из рассчитанного значения теплопотерь.
Например, приблизительная теплопотеря неизолированного защищенного помещения площадью 20 м² с высотой крыши 3 метра, расположенного в мезонине, составляет:
20x3x32 = 1920 ккал / ч.
Таким же образом, примерные потери тепла для дома площадью 150 м²:
.
150x3x32 = 14400 ккал / ч.
Отопительный прибор подбирается по найденному значению теплопотерь. Например. обычный комбинированный котел, конденсационный комбинированный котел и центральное отопление должны выполняться индивидуально, а центральный котел — центральным системным отоплением.
РАСЧЕТ МОЩНОСТИ ГОРЕЛКИ:
В случае использования котла продувочной системы; Расчет горелки, соответствующей мощности котла, производится по формуле:
Q к
Б Br =
H и . וּ руб.
B Br : Производительность горелки (кг / ч)
Q k : Производительность котла (ккал / ч)
וּ Br : КПД горелки (проверено по каталогу)
H u : Низкая теплота сгорания топлива (ккал / ч)
H u значения:
Дизель: 10200 ккал /
кг
Мазут номер 4: 10100 ккал / кг
СУГ: 11800 ккал / кг
Природный газ: 8250 ккал / м 3
Зонгулдакский карьер: 7000 ккал /
кг
Кокс: 6000 ккал / кг
Бурый уголь: 2000 — 5500 ккал /
кг
Ориентировочные значения וּ Br :
Бурый уголь: 0.65
Кокс и каменный уголь: 0,72
Мазут: 0,82
Природный газ: 0,92
РАСЧЕТ РАЗМЕРА ТРУБЫ:
При расчете размеров трубы скорость воды при наименьшем значении в ответвлениях должна увеличиваться по мере увеличения размера трубы и достигать максимальной скорости на входе в котел. Однако в системах водяного отопления 90 o C / 70 o C скорость воды не должна превышать 0,2-0,3 м / с, 1 м / с.в трубах до 2 ”и 1,5 м / сек. в трубах большего размера. Позже рассчитываются прямые трубы и локальные потери давления, и для системы выбирается насос.
ВЫБОР КЛАПАНОВ РАДИАТОРА:
Вы должны решить, использовать ли радиаторные клапаны с внутренней регулировкой расхода или термостатические радиаторные клапаны (TRV). В случае TRV вы предотвратите нагрев объемов сверх заданной температуры и обеспечите экономию топлива (каждый последующий нагрев на 1 ° C означает дополнительный расход топлива на 5%), а также получите более легкие комфортные условия и сделаете их постоянными.
Термостатический клапан радиатора
ВЫБОР И РАЗМЕЩЕНИЕ РАДИАТОРА:
Панельные или чугунные радиаторы выбираются из соответствующих каталогов в соответствии с величиной потерь тепла, рассчитанной для объема. Чугунные радиаторы имеют ряд секций, а панельные радиаторы — длину радиатора. Для размещения выбирается место с наибольшими потерями тепла (например, днище окон). Однако вы должны обратить внимание на тот факт, что эти значения рассчитаны для радиаторов с открытой окружающей средой.В случае, если часть радиаторов должна оставаться в закрытом положении (кладка мрамора на радиатор, установка радиатора в нишу или сетку и т. Д.), К расчетным значениям вносятся дополнения. В этом случае тепловые характеристики радиатора могут упасть до 80%. Радиаторы необходимо ставить как можно больше на пол. Для идеального размещения достаточно места от стены 4 см и дорожного просвета 6 см.
В чугунных чугунных радиаторах с более чем 20 секциями и панельных радиаторах длиной более 1,5 м возвратный патрубок должен быть взят с другого конца (поперечного соединения) радиатора.
Важное примечание: На практике ни одна система не работает при 90 o C / 70 o C. Поскольку они работают при 75 o C / 65 o C, вы должны спросить у производителей таблицу теплотворной способности радиаторов. по системе 75 o C / 65 o C.
ВЫБОР ЦИРКУЛЯЦИОННОГО НАСОСА
Расход циркуляционного насоса определяется количеством воды, циркулирующей в установке. Циркуляция воды в установке зависит от общей потребности установки в тепле и температуры воды в прямом обратном трубопроводе.
Q к
Q p =
Ц.п. (т г -т г )
Q p : Производительность насоса (м 3 / ч)
Q k : Потребление тепла (ккал / ч)
C: Удельная теплоемкость воды (1 ккал / кг o C)
p: Плотность воды (приблизительно 970 кг / м 3 для систем 90 o C / 70 o C)
t g : Температура поступающей воды
t d : Температура обратной воды
Однако это выражение не используется в типах нагревателей, поскольку тепловая мощность определяется по расходу.В этом случае учитываются рекомендации производителя нагревателя по расходу насоса.
Давление циркуляционного насоса: Давление циркуляционного насоса должно быть больше, чем коэффициент трения колонны, которая имеет самые высокие потери на трение и называется критическим контуром.
H p > ∑R.L + ∑Z мм SS
R.L: Прямые потери в трубе:
Z: Местные потери
Найденное значение давления увеличивается, если в расчетах учитываются потери котельной.Если потери котельной не учитываются, к расчетному значению прибавляется 300-800 мм рт. Ст.
Циркуляционный насос желательно работать в середине расхода по абсциссе (горизонтальная ось) и характеристической кривой давления по ординате (вертикальная ось). Есть запчасть на случай выхода из строя.
Насосы обычно подключаются к обратной линии. Если установка имеет большую емкость, центробежный насос, который используется вместо циркуляционного насоса подключен к выходной линии.Таким образом, в системе не остается критической точки для образования воздуха.
РАСЧЕТ РАСШИРИТЕЛЬНОГО БАКА:
Закрытый расширительный бак:
Его главная особенность заключается в том, что он блокирует проникновение кислорода воздуха в воду системы и предотвращает коррозию. Более того, в отличие от открытых расширительных баков, вода не испаряется и вызывает потери воды и тепла. Они изготавливаются цилиндрической, сферической, плоско-круглой и плоско-прямоугольной форм и размещаются в котельных.Таким образом устраняются проблемы размещения и замораживания. В системе обязательно должны быть предохранительный клапан и манометр.
Закрытые расширительные баки подходят только для котлов с автоматическим регулированием горения (жидкого и газового топлива). Его нельзя использовать в угольных котлах с ручной загрузкой, так как это может вызвать большие колебания температуры.
Имеются 6, 12 и 18 литровые модели для комнатных обогревателей в зависимости от тепловой мощности.
В практических расчетах за объем закрытого расширительного бака принимается 6% объема воды в системе.
Для того чтобы на практике найти объем воды в установке, можно использовать следующий метод:
Панельные радиаторы ПККП высотой 600 мм используются в основном на рынке. На 1 метр такого радиатора уходит почти 6 литров воды. Предположим, в квартире, отапливаемой центральным котлом, используется 100 метровый радиатор 600 ПККП. В этом случае общий объем воды в радиаторах составляет:
100х6 = 600 л.
Теперь предположим, что этот объем воды составляет 1000 литров, если мы добавим приблизительное количество воды в установку и бойлер, глядя на значение по каталогу.
В этом случае объем расширительного бака, необходимый для системы, составляет:
1.000х0.06 = 60 литров.
Открытый расширительный бак:
Они используются в твердотопливных системах, так как отсутствует возможность контроля пламени. Температура воды не превышает 100 o C, так как давление в системе не превышает 1 бар. В систему необходимо добавить новую воду, так как вода при контакте с атмосферой испаряется. Кислород в недавно добавленной воде вызывает коррозию.Важным моментом является то, что прямые и обратные трубопроводы безопасности не отсечной клапан. Предохранительные трубы — это прямые и обратные предохранительные трубы, которые передают количество теплоносителя, увеличившееся в объеме из-за разницы температур, в частности повышения температуры в теплогенераторе, то есть в котле и установке, к расширительному депо. Передняя труба должна подключаться сверху, а обратная предохранительная труба должна подключаться снизу. В этом случае вода будет течь из передней предохранительной трубы в расширительное депо, если давление водяного насоса будет больше требуемого значения.Поскольку такой поток нежелателен, либо к системе должен быть подключен насос с меньшим давлением, либо поток воды в расширительное депо должен быть предотвращен путем регулировки байпасного клапана в насосной станции.
Нормальный уровень воды в установке — это когда вода составляет 90 o C и расширительный бак заполнен. Уровень воды считывается в mSS (счетчик водяного столба) с ареометра, прикрепленного к котлу или коллектору.
Трубка сообщения, которая подсоединяется к расширительному депо от минимального уровня воды и проложена до котельной, и на ее конце прикреплен клапан (1/2 дюйма), помогает проверить, достаточно ли воды в установке.
Передний и возвратный предохранительные трубы не могут быть меньше 1 дюйма. Расширительные баки входят в объем TS 713.
Расчет объема открытого расширительного бака производится так же, как и расчет объема закрытого расширительного бака.
Расчет свойств газа — PetroWiki
На этой странице представлен ряд примеров, иллюстрирующих математические вычисления, лежащие в основе различных основных свойств газа.
Расчетные свойства природного газа
Найдите плотность, коэффициент объема пласта (FVF), вязкость и изотермическую сжимаемость газа со следующими свойствами и условиями:
- γ г = 0.7
- H 2 S = 7%
- CO 2 = 10%
- p = 2,010 фунтов на квадратный дюйм
- T = 75 ° F.
Решение
Плотность рассчитывается по формуле. 3 дюйма Объемный коэффициент и плотность газового пласта:
Коэффициент объема пласта рассчитывается по формуле. 2 в Факторе объема и плотности газового пласта:
Вязкость определяется с использованием диаграмм Carr et al. [1] на фиг. 1-4 дюйма Вязкость газа.
- Сначала вязкость для M г = (0,7) (28,967) = 20,3 при p = 1 атм и T = 75 ° F считывается из рис. 2.
- Это дает 0,0102 сП, но необходимы поправки для кислых газов. Поправка для 10% CO 2 составляет 0,0005 сП, а поправка для 7% H 2 S составляет 0,0002 сП. Следовательно, это дает μ ga = 0,0109 cp.
- Затем соотношение μ g / μ ga считывается с рис.4, что дает μ g / μ ga = 1.55.
- Следовательно, μ г = (1,55) (0,0109 cp) = 0,0169 cp.
Сжимаемость определяется при первом чтении Рис. 1-2 в Изотермическая сжимаемость газов для ранее рассчитанных значений p r = 3.200 и T r = 1.500, чтобы получить c r T r = 0,5. Поскольку T r = 1.500, тогда c r = 0.5 / 1.5 = 0.3333. Потому что c r = c g p pc ,
Расчет относительной плотности (удельного веса)
Рассчитайте относительную плотность (удельный вес) природного газа следующего состава (все составы указаны в мол.%):
| С 1 | = | 83.19% |
| С 2 | = | 8,48% |
| С 3 | = | 4,37% |
| i -C 4 | = | 0,76% |
| n -C 4 | = | 1,68% |
| i -C 5 | = | 0,57% |
| n -C 5 | = | 0.32% |
| С 6 | = | 0,63% |
| Итого | = | 100% |
Решение .
Сначала вычислите кажущийся мольный вес на основе информации, представленной в Таблица 1 .
, где молекулярная масса воздуха M a равна 28,967.
Расчет фактической плотности
Рассчитайте фактическую плотность той же смеси при 1525 фунт / кв.дюйм и 75 ° F
- Использование правил Кея [2]
- Корреляция Саттона [3]
- Piper et al. [4] корреляция.
Решение .
Плотность рассчитывается по
где
- p = 1525 фунтов на кв. Дюйм
- M г = 20,424
- R = 10,7316 (фунт / дюйм2 3 ) / (фунт-моль ° R)
- T = 75 ° F + 459,67 = 534,67 ° R
- z должно быть получено из рис. 2 в реальных газах
1.Вычислите z g из известного состава в таблице 2 .
Используя правила Кея [2] , мы получаем из известного состава газа:
T шт. = Σ y i T i = 393,8 ° R,
T пр = 534,67 / 393,8 = 1,3577,
p шт = Σ y i p ci = 662.88 фунтов на квадратный дюйм,
p пр = p / p шт = 1525 / 662,88 = 2,301,
и из Рис.1 , z g = 0,71.
2. Из газового гравитационного метода Саттона [3] γ г = 0,705; тогда мы получаем из уравнения. 4-5 в реальных газах, которые
Это дает
Из рис.2 в реальных газах, получаем z g = 0,745.
3. Использование Piper et al. [4] метод, мы сначала вычисляем J и K , используя
Детали расчетов можно найти в Табл. 2 .
Тогда,
Наконец, поиск по диаграмме коэффициентов z (рис. 2 в реальных газах) дает z = 0,745.
Заключение .
Хотя корреляция Саттона [3] и Piper et al. [4] корреляция дала несколько разные критические свойства, коэффициенты z этих двух методов одинаковы. Правило Кея [2] дает значение, которое на 4,6% ниже, но результат с использованием корреляции Саттона и Piper et al. Корреляция оказалась более точной. Тогда плотность определяется как
Расчет коэффициента z для пластовой жидкости
Рассчитайте коэффициент z для пластового флюида в Таблица 3 при 307 ° F и 6098 фунтах на квадратный дюйм.
Экспериментальное значение z = 0,998.
Решение .
Использование Piper et al. [4] метод, мы сначала вычисляем J и K , используя
Подробности расчета приведены в таблице 4 .
Тогда,
Наконец, просмотрев диаграмму коэффициентов z (рис.2 в реальных газах) дает z = 1,02. Это представляет собой ошибку в 2% от экспериментального значения.
Номенклатура
| Дж | = | в Stewart et al. [5] уравнений, К • Па –1 |
| К | = | в Stewart et al. [5] уравнений, К • Па –1/2 |
| M | = | молекулярная масса |
| M a | = | молекулярная масса воздуха |
| = | молекулярная масса фракции C 7+ | |
| M г | = | средняя молекулярная масса газовой смеси |
| n | = | количество родинок |
| п. | = | абсолютное давление, Па |
| p c | = | критическое давление, Па |
| p шт | = | псевдокритическое давление газовой смеси, Па |
| p r | = | пониженное давление |
| рэнд | = | газовая постоянная, Дж / (г · моль-К) |
| Т | = | абсолютная температура, К |
| T c | = | критическая температура, К |
| T ci | = | критическая температура компонента и в газовой смеси, К |
| T шт | = | скорректированная псевдокритическая температура, К |
| T r | = | пониженная температура |
| z | = | коэффициент сжимаемости (коэффициент отклонения по газу) |
| ρ шт | = | относительная плотность фракции C 7+ |
| μ г | = | вязкость газа, Па • с |
| B г | = | объемный коэффициент газового пласта (RB / scf или Rm 3 / Sm 3 ) |
| μ га | = | Вязкость газовой смеси при заданной температуре и атмосферном давлении, Па • с |
| c г | = | коэффициент изотермической сжимаемости |
| c r | = | безразмерная псевдосжимаемость газа |
| Дж | = | в Stewart et al. [5] уравнений ( уравнения 5.9 и 5.10 ), К • Па –1 |
| К | = | в Stewart et al. [5] уравнений ( уравнения 5.9 и 5.10 ), К • Па –1/2 |
| ρ г > | = | плотность газа, кг / м 3 |
Литература
- ↑ Карр, Н.Л., Кобаяши Р., Берроуз Д. Б. 1954. Вязкость углеводородных газов под давлением. J Pet Technol 6 (10): 47-55. SPE-297-G. http://dx.doi.org/10.2118/297-G
- ↑ 2,0 2,1 2,2 Кей, У. Б.: «Плотность углеводородных газов при высокой температуре и давлении», Ind. Eng. Chem. (Сентябрь 1936 г.) 28, 1014–1019.
- ↑ 3,0 3,1 3,2 Саттон, Р.П .: «Коэффициенты сжимаемости для высокомолекулярных пластовых газов», доклад SPE 14265, представленный на Ежегодной технической конференции и выставке SPE 1985 г., Лас-Вегас, Невада, 22–25 Сентябрь.
- ↑ 4,0 4,1 4,2 4,3 Пайпер, Л.Д., Маккейн, У.Д. младший и Корредор, Дж. Х .: «Коэффициенты сжимаемости для природных нефтяных газов», доклад SPE 26668, представленный на Ежегодной технической конференции SPE 1993 г. и выставка, Хьюстон, 3–6 октября. Ошибка цитирования: недопустимый тег
- ↑ 5,0 5,1 5,2 5,3 Стюарт, В.Ф., Буркхардт С.Ф. и Ву Д.: «Прогнозирование псевдокритических параметров смесей», представленное на встрече Айше в 1959 году, Канзас-Сити, Миссури, 18 мая. [редактировать]
Интересные статьи в OnePetro
Используйте этот раздел, чтобы перечислить статьи в OnePetro, которые читатель, желающий узнать больше, обязательно должен прочитать
Внешние ссылки
Используйте этот раздел для предоставления ссылок на соответствующие материалы на других веб-сайтах, кроме PetroWiki и OnePetro.


 Для ее применения необходим опыт. Этот инструмент подходит для мастеров, которые уже давно занимаются строительством. Если же вы новичок в этом деле, то вам будет немудрено запутаться и получить совершенно неверные результаты.
Для ее применения необходим опыт. Этот инструмент подходит для мастеров, которые уже давно занимаются строительством. Если же вы новичок в этом деле, то вам будет немудрено запутаться и получить совершенно неверные результаты. А если вы решите воспользоваться специальным клеевым составом, то скрепляющие слои будут гораздо тоньше,
А если вы решите воспользоваться специальным клеевым составом, то скрепляющие слои будут гораздо тоньше,
 В данном случае она равняется 2,7 м. Высота цокольного этажа 0,4 м не учитывалась в общей высоте постройки. При расчетах надо иметь это в виду;
В данном случае она равняется 2,7 м. Высота цокольного этажа 0,4 м не учитывалась в общей высоте постройки. При расчетах надо иметь это в виду; = 1258 кубометров;
= 1258 кубометров; Несмотря на то, что газоблоки имеют меньший вес, чем стандартный кирпич, большой его объем можно перевезти только при заказе грузового автомобиля. Если окажется, что нужно было больше материала, то придется снова заказывать транспорт.
Несмотря на то, что газоблоки имеют меньший вес, чем стандартный кирпич, большой его объем можно перевезти только при заказе грузового автомобиля. Если окажется, что нужно было больше материала, то придется снова заказывать транспорт.

