Расход жидкого стекла на 1 м3 раствора: пропорции, свойства, видео технологии замешивания
- Расход материалов
- Кислотоупорный бетон на жидком стекле
- Расход материалов для укладки кислотоупорной плитки и кирпича
- Измерение объема
- Очистка лабораторной посуды
- Density—Sink and Float для жидкостей | Глава 3: Плотность
- Как рассчитать плотность твердых тел и жидкостей — видео и стенограмма урока
- Плотность (удельный вес) – обзор
- Аварийная дезинфекция питьевой воды
- Учебное пособие по физике
Расход материалов
Норматив расхода огнеупорных материалов.
Смесь огнеупорная (мертель Мш-28,31,36,39) расход 30-40 кг готовой смеси на 100 шт огнеупорного кирпича или печного кирпича.
Норматив расхода кислотоупорных материалов.
Ориентировочные нормы расхода материалов для грунтовки бетонной поверхности, поклейки полиизобутиленом, укладки кислотоупорной плитки и кирпича, расшивок швов. Подробная информация имеется в ВСН 214 и строительном сборнике №13. При проектировании сложных покрытий большой площади рекомендуем обратиться за помощью к проектно-сметной организации.
Подготовка бетонной поверхности.
Подготовка бетонной поверхности заключается в ее грунтовке смолой ЭД-20, эпоксидным праймером ЭП-01 или оклейке полиизобутиленовой пластиной ПСГ на клей 88.
Расход материалов:
— Смола ЭД-20 — 0,5 кг/м2;
— Праймер ЭП 01 — 0,5 кг/м2;
— Полиизобутиленовая пластина ПСГ (в один слой) — 4 кг/м2;
— Клей 88 — 0,5 кг/м2.
Укладка плитки и кирпича на силикатную замазку.
Для приготовления силикатной замазки используется кислотоупорный порошок, жидкое стекло и натрий кремнефтористый.
На 1 м2 Диабазовая мука, кг; Жидкое стекло, кг; Натрий кремнефтористый, кг.
Плитка 20мм 17.6, 8.27, 1.23;
35мм 18,7 8,65 1,30;
Кирпич плашмя 23.7, 10.7, 1.62;
на ребро 33.6, 14.8, 2.23;
Укладка плитки на клей Химфлекс
Ориентировочный расход клея Химфлекс для укладки плитки составляет:
— Химфлекс HN — 6..8 кг/м2;
— Химфлекс 2КХ — 5..6 кг/м2;
Укладка плитки и кирпича на замазку арзамит.
Арзамит порошок и арзамит раствор смешиваются непосредственной перед укладкой. Пропорции для приготовления замазки приведены в таблице. Этого количества должно хватить на укладку и последующую расшивку швов.
На 1 м2 Арзамит-порошок Арзамит-раствор.
Плитка 20мм 5.45, 4.33;
35мм 6,31 5,00;
Кирпич плашмя 9,60 7,35;
на ребро 16,60 13,00;
Расшивка швов.
Расход замазки арзамит на расшивку швов приведен в таблице.
На 1 м2 Арзамит-порошок Арзамит-раствор
Плитка 20мм 0.79, 0.65;
35мм 1.38, 1.14;
Кирпич плашмя 2.57, 2.11;
на ребро 4.46, 3.67;
Расход затирки Химфлекс 2Ф:
— для плитки 300х300х20 — 1,1 кг/м2
— для плитки 200х200х20 — 1,6 кг/м2
— для плитки 200х200х30мм — 2,2 кг/м2
— для плитки 230х113х20мм — 2,4 кг/м2
Нормы расхода в обьемах.
Для приготовления 1 м3 силикатной замазки требуется:
— кислотоупорного порошка 1,24тн;
— жидкого стекла 0,63тн;
— натрия кремнефтористого 94кг;
Для приготовления 1 м3 готовой замазки арзамит требуется:
— арзамит-порошка 0,65тн;
— арзамит-раствора 0,55тн.
Кислотоупорный бетон на жидком стекле
Обычные цементные бетоны, несмотря на все меры по их уплотнению и пропитке, имеют далеко не достаточную стойкость в кислых средах. Поэтому, естественно, возникает вопрос о целесообразности использования специальных кислтоупорных бетонов, особенно кладочных и штукатурных растворов и мастик.
К таким бетонам можно отнести составы с использованием в качестве вяжущего жидкого (растворимого) стекла и серного цемента, а также битумных и пековых составов.
Под мастикой, замазкой или тестом, описанными далее, нужно понимать материалы на основе вяжущего с необходимыми отвердителями и микронаполнителями, под растворами — те же смеси, но с добавлением строительного песка, а под бетонами — те же материалы с добавками щебня.
Кислотоупорные замазки, растворы и бетоны на жидком стекле.
Вяжущим материалом для кислотоупорных составов являются натриевое или калиевое жидкое стекло.
Кремнеземистый модуль (отношение содержания кремнезема к содержанию окиси натрия или калия) натриевого жидкого стекла должен быть не ниже 2,2 (обычно 2,6—3), а калиевого не ниже 2,8, удельный вес раствора в пределах 1,4—1,5; для повышения водостойкости бетонов модуль натриевого жидкого стекла рекомендуется принимать не ниже 3.
В качестве отвердителя применяют кремнефтористый натрий 1-го и 2-го сорта. Содержание чистого продукта должно быть не менее 93%, влажность — не более 1 %.
Содержание чистого продукта должно быть не менее 93%, влажность — не более 1 %.
Наполнителем служат пылевидные (молотые) порошки, приготовляемые из природных или искусственных кислотостойких силикатных материалов — андезита, базальта, бештаунита, диабаза, кварца, фельзита, пемзы, маршалита, каменного литья, кислотоупорной керамики. Кислотостойкость порошков, определенная по ГОСТ, должна быть не ниже 96%, влажность не более 2%, тонкость помола должна соответствовать требованиям ГОСТ (остаток на сите № 92 или примерно 900 отв/см2 не должен быть более 0,5%).
В качестве заполнителей для растворов и бетонов применяют песок и щебень из тех же пород, а также кварца, гранита и других кислотостойких пород. Влажность песка не должна превышать 5%, щебня — 0,5%. Зерновой состав заполнителя должен удовлетворять требованиям получения плотных смесей. Кислотостойкость песка и щебня принимается не ниже 96%.
Рекомендуемые усредненные составы замазок, растворов и бетонов приведены в табл.
При наличии хорошего подбора заполнителей по плотности расход жидкого стекла в бетоне может быть уменьшен на 10—20%, а в случае если к бетону не предъявляется особых требований по плотности —до 30%.
Кислотоупорные бетоны, растворы и замазки на жидком стекле достаточно стойки к действию концентрированных кислот, за исключением плавиковой и фосфорной (при повышенной температуре) .
Кислоты малой концентрации более агрессивны для кислотостойкого бетона, при их действии наблюдается некоторое снижение прочности, а обычная вода разрушает бетон на жидком стекле за 5—10 лет. Особенно агрессивно действуют щелочные растворы, при наличии которых применять кислотоупорные составы не следует.
Для повышения кислотостойкости бетона и замазки на жидком стекле после их начального отвердевания рекомендуется их «окисловать», т. е. обработать раствором серной или лучше соляной кислоты.
Для повышения водостойкости таких бетонов рекомендуется применять жидкое стекло с повышенным силикатным модулем (2,8—3,2), увеличивать добавку кремнефтористого натрия (до 16—18%) и прогревать уплотненный бетон при 100—150°С в течение 8—12 ч.
Кислотоупорные бетоны и замазки являются малоплотными, с фильтрующей пористостью от 10 до 30% и водопоглощением от 6 до 15%. Рекомендуется использовать также в качестве подслоя под такие футеровки весьма плотные материалы, например полиизобутилен.
Состав бетонов на жидком стекле
Ориентировочные составы плотных кислотостойких замазок, растворов и бетонов на основе жидкого стекла приведеные в таблице.
| Составляющие | Расход материалов в кг/м3 | ||
| замазки | раствора | бетона | |
| Жидкое стекло с удельным весом 1,4—1,5 | 600 | 400 | 300 |
| Кремнефтористый натрий | 100 | 60 | 50 |
| Пылевидный наполнитель | 1300 | 440 | 400 |
| Песок средней крупности | — | 1300 | 550 |
| Щебень, разделенный на 2—3 фракции (5—10, 10—20, 20—40 мм) | — | — | 1100 |
| Общий вес материалов в кг/м3 | 2000 | 2200 | 2300 |
Прочность бетонов на жидком стекле составляет обычно 200— 300 кгс/см2, реже до 400 кгс/см2.
Наибольшие величины прочности наблюдаются у прогретых образцов, однако при последующем длительном выдерживании в воде это преимущество не сохраняется.
При выдерживании образцов в воде до года обычно наблюдается снижение прочности их, особенно при растяжении или изгибе на 20—30, а иногда и на 50%.
Расход материалов для укладки кислотоупорной плитки и кирпича
Ниже приводятся ориентировочные нормы расхода материалов для грунтовки бетонной поверхности, оклейке полиизобутиленом, укладки кислотоупорной плитки и кирпича, расшивки швов. Более подробная информация имеется в ВСН 214 и строительном сборнике №13, с которыми вы можете ознакомиться в разделе сборники и справочники. При проектировании сложных покрытий большой площади настоятельно рекомендуем обратиться за помощью к проектно-сметной организации.
Подготовка бетонной поверхности
Подготовка бетонной поверхности заключается в ее грунтовке смолой ЭД-20, эпоксидным праймером ЭП-01 или оклейке полиизобутиленовой пластиной ПСГ на клей 88.
Расход материалов:
— Смола ЭД-20 — 0,5 кг/м2;
— Праймер ЭП 01 — 0,5 кг/м2;
— Полиизобутиленовая пластина ПСГ (в один слой) — 4 кг/м2;
— Клей 88 — 0,5 кг/м2.
Укладка плитки и кирпича на силикатную замазку
Для приготовления силикатной замазки используется кислотоупорный порошок, жидкое стекло и натрий кремнефтористый. Расход материалов для приготовления замазки приведены в таблице.
| На 1 м2 | Диабазовая мука, кг | Жидкое стекло,кг | Натрий кремнефтористый, кг | |
| Плитка | 20мм | 17,6 | 8,27 | 1,23 |
| 35мм | 18,7 | 8,65 | 1,30 | |
| Кирпич | плашмя | 23,7 | 10,7 | 1,62 |
| на ребро | 33,6 | 14,8 | 2,23 | |
Укладка плитки на клей Химфлекс
Ориентировочный расход клея Химфлекс для укладки плитки составляет:
— Химфлекс HN — 6.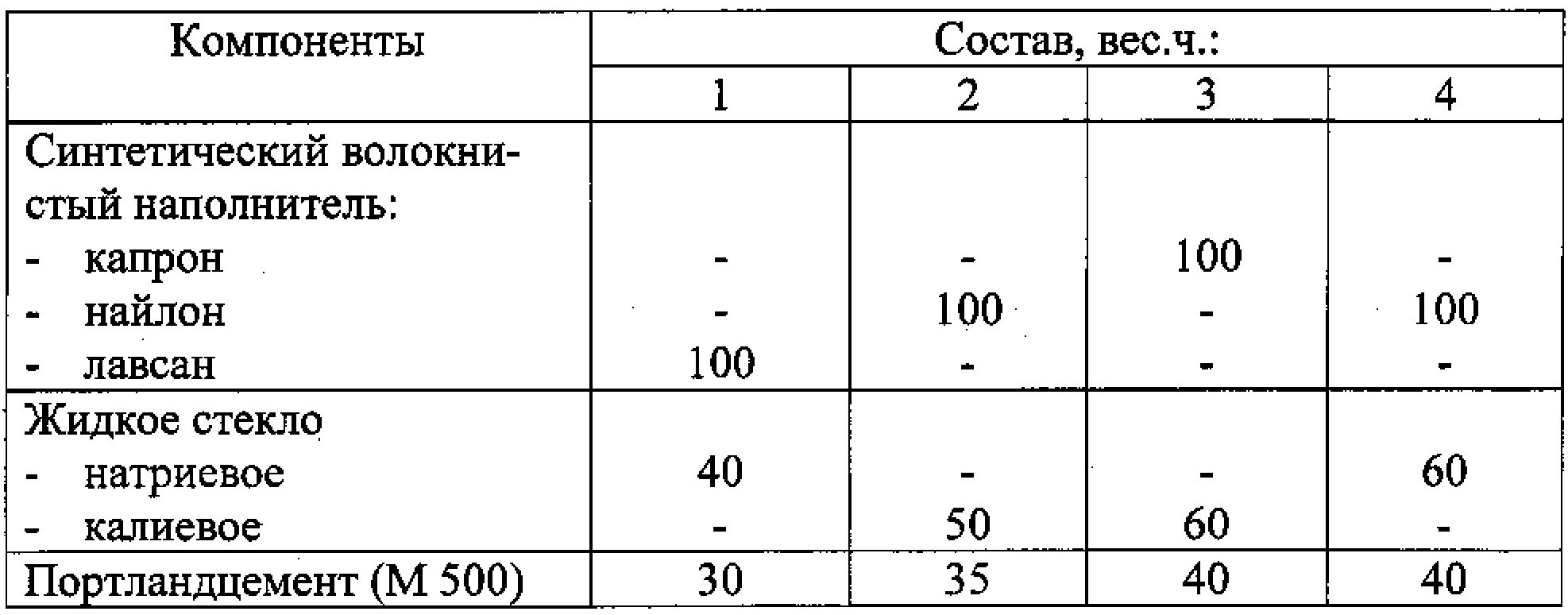 .8 кг/м2;
.8 кг/м2;
— Химфлекс 2КХ — 5..6 кг/м2;
Следует иметь в виду, что расход сильно зависит от толщины подплиточного слоя. На неровных поверхностях расход может быть больше в 2 раза.
Укладка плитки и кирпича на замазку арзамит
Арзамит порошок и арзамит раствор смешиваются непосредственной перед укладкой. Пропорции для приготовления замазки приведены в таблице. Этого количества должно хватить на укладку и последующую расшивку швов.
| На 1 м2 | Арзамит-порошок | Арзамит-раствор | |
| Плитка | 20мм | 5,45 | 4,33 |
| 35мм | 6,31 | 5,00 | |
| Кирпич | плашмя | 9,60 | 7,35 |
| на ребро | 16,60 | 13,00 | |
Расшивка швов
Расход замазки арзамит на расшивку швов приведен в таблице.
| На 1 м2 | Арзамит-порошок | Арзамит-раствор | |
| Плитка | 20мм | 0,79 | 0,65 |
| 35мм | 1,38 | 1,14 | |
| Кирпич | плашмя | 2,57 | 2,11 |
| на ребро | 4,46 | 3,67 | |
Расход затирки Химфлекс 2Ф:
— для плитки 300х300х20 — 1,1 кг/м2
— для плитки 200х200х20 — 1,6 кг/м2
— для плитки 200х200х30мм — 2,2 кг/м2
— для плитки 230х113х20мм — 2,4 кг/м2
Объемные нормы расхода
Для приготовления 1 м3 силикатной замазки требуется:
— кислотоупорного порошка 1,24тн;
— жидкого стекла 0,63тн;
— натрия кремнефтористого 94кг;
Для приготовления 1 м3 готовой замазки арзамит требуется:
— арзамит-порошка 0,65тн;
— арзамит-раствора 0,55тн;
Измерение объема
Измерение объема
Измерение объема жидкостей |
Некоторая химическая посуда, называемая мерной посудой, снабжена маркировкой, облегчающей измерение объема жидкостей. Предметы мерной посуды, найденные в химической лаборатории, представляют собой мензурки, колбы Эрленмейера, мерные цилиндры, пипетки, бюретки и мерные колбы.
Предметы мерной посуды, найденные в химической лаборатории, представляют собой мензурки, колбы Эрленмейера, мерные цилиндры, пипетки, бюретки и мерные колбы.
Доставить и содержать
Мерную стеклянную посуду можно разделить на две категории: те, которые предназначены для содержания определенного количества жидкости, и те, которые предназначены для подачи определенного количества жидкости.Стеклянная посуда, предназначенная для хранения, например мерных цилиндров и мерных колб, обычно маркируется ТС. Когда жидкость выливается из стеклянной посуды, ее небольшое количество остается, прилипая к стенкам сосуда. Мерная колба на 100 мл рассчитана на то, чтобы вместить ровно 100 мл, но если жидкость вылить, то фактически получится чуть меньше 100 мл. Стеклянная посуда, предназначенная для доставки, такая как пипетки и бюретки, маркируется TD. Эти кусочки стеклянной посуды составляют небольшое количество оставшейся жидкости.Пипетка на 100 мл содержит чуть больше 100 мл жидкости, но при сливе жидкости из пипетки выдается ровно 100 мл.
Мениск
Когда вода помещается в стеклянный или пластиковый контейнер, поверхность принимает изогнутую форму. Эта кривая известна как мениск. Мерная стеклянная посуда откалибрована таким образом, чтобы измерение дна мениска, если смотреть на него на уровне глаз, давало точные результаты. Просмотр мениска под любым другим углом даст неточные результаты.
Точность
Точность маркировки на мерной стеклянной посуде сильно различается. Маркировка на стаканах и колбах обычно составляет около плюс-минус 5% от объема контейнера. Таким образом, их следует использовать только тогда, когда требуется приблизительная оценка объема. Допуск для градуированных цилиндров составляет около 1%. Мерные колбы, бюретки и пипетки являются наиболее точными с допусками менее 0,2%. Для достижения такой точности человеку, использующему устройство, необходимо использовать надлежащую технику, а измерения необходимо проводить при температуре, для которой была откалибрована стеклянная посуда (обычно 20 градусов C).
Правильная техника
Прочтите о правильной технике пипетирования
. Читайте о правильной технике бюретки.Очистка лабораторной посуды
ОСТОРОЖНО: Всегда автоклавируйте сосуды с незакрепленными крышками или крышками.
Время стерилизации паром не должно превышать 15 минут при температуре 121 °C (250 °F). Время высыхания не должно превышать 15 минут при температуре 110 °C (230 °F). Следует проверить фактическую температуру полости автоклава, чтобы убедиться, что температура автоклава не превышает рекомендуемую температуру стерилизации и сушки.
Автоклавирование-облачность
Если покрытие помутнело из-за растворенной влаги, просто дайте ему высохнуть в течение ночи при комнатной температуре или кратковременно нагрейте до 110 °C (230 °F).
Очистка
В соответствии с общепринятой практикой очистите всю стеклянную посуду перед использованием. Любое неабразивное моющее средство для стеклянной посуды можно использовать для ручной или автоматической мойки посудомоечной машины. При использовании посудомоечной машины или сушилки для стеклянной посуды следите за тем, чтобы температура сушки не превышала 110 °C (230 °F).Воздействие сухого тепла должно быть сведено к минимуму.
При использовании посудомоечной машины или сушилки для стеклянной посуды следите за тем, чтобы температура сушки не превышала 110 °C (230 °F).Воздействие сухого тепла должно быть сведено к минимуму.
Избегайте щеток и чистящих подушечек, которые могут стереть стекло или повредить покрытие. При использовании очищающего раствора хромовой кислоты сведите к минимуму контакт раствора с покрытием.
Этикетирование и маркировка
Используйте маркеры на водной основе для временной маркировки или маркировки покрытия лабораторной посуды PyrexPlus ® . Маркеры на основе растворителей, красители и морилки не могут быть удалены с покрытия.
ПРИМЕЧАНИЕ: При обращении с лабораторной посудой PyrexPlus ® может ощущаться легкий «пластиковый» запах.Это связано с добавками в пластиковом покрытии, которые отвечают за его превосходные характеристики. Запах является нормальным и не влияет на инертность внутренней поверхности боросиликатного стекла.
Дополнительную информацию см. в документе «Использование и уход за лабораторной стеклянной посудой PyrexPlus ® » .
Бюретки
Снимите запорный кран или резиновый наконечник и промойте бюретку моющим средством и водой. Промойте водопроводной водой, пока вся грязь не будет удалена. Затем промыть дистиллированной водой и высушить.Отдельно вымойте запорный кран или резиновый наконечник. Перед помещением в бюретку стеклянного крана смажьте соединение смазкой для кранов. Используйте только небольшое количество смазки. Бюретки всегда должны быть закрыты, когда они не используются.
Пробирки для культур
Культуральные пробирки, которые использовались ранее, должны быть стерилизованы перед очисткой. Наилучший метод стерилизации культуральных пробирок — автоклавирование в течение 30 минут при 121 °C (давление 15 фунтов на кв. дюйм). Среду, которая затвердевает при охлаждении, следует выливать, пока пробирки горячие.После опорожнения трубок почистите их моющим средством и водой, тщательно промойте водопроводной водой, ополосните дистиллированной водой, поместите в корзину и высушите.
Если пробирки должны быть заполнены средой, стерилизованной автоклавированием, не затыкайте их, пока среда не будет добавлена. Таким образом, и среда, и пробирки стерилизуются в одном автоклаве.
Если пробирки должны быть заполнены стерильной средой, закройте и простерилизуйте пробирки в автоклаве или суховоздушном стерилизаторе перед добавлением среды.
Чашки и бутыли для культур
Стерилизуйте и очистите, как описано в разделе «Пробирки для культивирования».Заверните в плотную бумагу или поместите в чашку Петри. Стерилизовать в автоклаве или суховоздушном стерилизаторе.
Пипетка
Поместите пипетки кончиками вниз в цилиндр или высокую банку с водой сразу после использования. Не бросайте их в банку. Это может сломать или отколоть наконечники и сделать пипетки бесполезными для точных измерений. Подушечка из ваты или стекловаты на дне банки поможет предотвратить поломку кончиков. Убедитесь, что уровень воды достаточно высок, чтобы погрузить большую часть или всю каждую пипетку. Затем пипетки можно слить и поместить в цилиндр или банку с растворенным моющим средством или, если они сильно загрязнены, в банку с чистящим раствором хромовой кислоты. После замачивания в течение нескольких часов или на ночь слейте воду из пипеток и пропустите через них водопроводную воду, пока все следы грязи не будут удалены. Замочите пипетки в дистиллированной воде не менее чем на один час. Выньте из дистиллированной воды, промойте, высушите снаружи тканью, стряхните воду и высушите.
Затем пипетки можно слить и поместить в цилиндр или банку с растворенным моющим средством или, если они сильно загрязнены, в банку с чистящим раствором хромовой кислоты. После замачивания в течение нескольких часов или на ночь слейте воду из пипеток и пропустите через них водопроводную воду, пока все следы грязи не будут удалены. Замочите пипетки в дистиллированной воде не менее чем на один час. Выньте из дистиллированной воды, промойте, высушите снаружи тканью, стряхните воду и высушите.
Пипетки для разведения клеток крови
После использования тщательно промойте прохладной водопроводной водой, дистиллированной водой, спиртом или ацетоном, а затем эфиром.Сушить отсасыванием. Не дуйте в пипетки, так как это приведет к конденсации влаги внутри пипетки.
Для удаления частиц свернувшейся крови или грязи следует использовать чистящий раствор. В одном случае достаточно одного типа раствора, в другом может потребоваться более сильное решение. Лучше всего заполнить пипетку очищающим раствором и оставить на ночь. Можно использовать гипохлорит натрия (отбеливатель для стирки) или моющее средство. Также полезна перекись водорода. В сложных случаях используйте концентрированную азотную кислоту.Для некоторых частиц может потребоваться разрыхление с помощью конского волоса или тонкой проволоки. Будьте осторожны, чтобы не поцарапать внутреннюю часть пипетки.
Можно использовать гипохлорит натрия (отбеливатель для стирки) или моющее средство. Также полезна перекись водорода. В сложных случаях используйте концентрированную азотную кислоту.Для некоторых частиц может потребоваться разрыхление с помощью конского волоса или тонкой проволоки. Будьте осторожны, чтобы не поцарапать внутреннюю часть пипетки.
Автоматическая мойка пипеток
Если ежедневно используется большое количество пипеток, удобно использовать автоматическую мойку пипеток. Некоторые из них, изготовленные из металла, могут быть подключены с помощью стационарной арматуры напрямую к горячему и холодному водоснабжению. Другие, например сделанные из полиэтилена, можно подсоединить к водопроводу с помощью резинового шланга. Полиэтиленовые корзины и банки можно использовать для замачивания и ополаскивания пипеток в чистящем растворе хромовой кислоты.Также доступны сушилки для металлических пипеток с электрическим обогревом.
После высыхания поместите пипетки в непыльный ящик. Серологические и бактериологические пипетки завернуть в бумагу или поместить в банки для пипеток и стерилизовать в суховоздушном стерилизаторе. Пипетки, используемые для переноса инфекционного материала, перед стерилизацией должны иметь хлопчатобумажную пробку на верхнем конце пипетки. Заглушка предотвратит случайное попадание измеряемого материала в пипеточное устройство.
Серологические и бактериологические пипетки завернуть в бумагу или поместить в банки для пипеток и стерилизовать в суховоздушном стерилизаторе. Пипетки, используемые для переноса инфекционного материала, перед стерилизацией должны иметь хлопчатобумажную пробку на верхнем конце пипетки. Заглушка предотвратит случайное попадание измеряемого материала в пипеточное устройство.
Серологические пробирки
Серологические пробирки должны быть химически чистыми, но не обязательно стерильными.Однако образцы крови, которые должны храниться некоторое время при комнатной температуре, должны быть собраны в стерильный контейнер. Может оказаться целесообразным стерилизовать все пробирки.
Чтобы очистить и стерилизовать пробирки с кровью, выбросьте сгустки в контейнер для отходов и поместите пробирки в большую корзину. Положите корзину вместе с другими в большое ведро или котел. Залейте водой, добавьте достаточное количество мягкого мыла или моющего средства и кипятите 30 минут. Промойте трубки, очистите щеткой, промойте и высушите, соблюдая обычные меры предосторожности.
Промойте трубки, очистите щеткой, промойте и высушите, соблюдая обычные меры предосторожности.
Крайне важно, чтобы при мытье серологической стеклянной посуды были полностью удалены все кислоты, щелочи и моющие средства. Кислоты, щелочи и детергенты в небольших количествах препятствуют серологическим реакциям. Серологические пробирки и стеклянную посуду следует хранить отдельно от другой стеклянной посуды и использовать только для серологических процедур.
Предметные стекла и покровное стекло
Особенно важно, чтобы предметные стекла микроскопа и покровные стекла, используемые для подготовки мазков крови или бактериологических мазков, были идеально чистыми и не имели царапин.Предметные стекла следует промыть, поместить в ледяную уксусную кислоту на 10 минут, промыть дистиллированной водой и вытереть насухо чистыми бумажными полотенцами или тканью. После того, как слайды были вымыты, поместите их в широкую банку со спиртом. При необходимости достаньте из банки и вытрите насухо. Если предметные стекла хранятся в сухом месте, перед использованием промойте их спиртом.
Если предметные стекла хранятся в сухом месте, перед использованием промойте их спиртом.
1. Очищающий раствор хромовой кислоты. Используйте порошкообразный дихромат натрия или дихромат калия коммерческого или технического качества. Если соединение находится в форме кристаллов, растереть в ступке до состояния мелкого порошка.К 20 граммам порошка в литровом стакане добавить немного воды, достаточное, чтобы получилась жидкая паста. Медленно добавьте приблизительно 300 мл промышленной концентрированной серной кислоты, хорошо перемешивая. Перелить в бутылку с пробкой.
Можно приготовить большее количество в тех же пропорциях. Используйте прозрачный раствор супернатанта. Раствор хромовой кислоты можно использовать повторно, пока он не станет зеленоватым. Утилизировать согласно соответствующим правилам. Перед выбрасыванием разбавьте большим количеством воды или осторожно нейтрализуйте разбавленный раствор гидроксидом натрия.Раствор хромовой кислоты сильно кислый и сильно обжигает кожу. Будьте осторожны в обращении с ним.
Будьте осторожны в обращении с ним.
Density—Sink and Float для жидкостей | Глава 3: Плотность
Ключевые понятия
- Поскольку плотность является характеристическим свойством вещества, каждая жидкость имеет свою характеристическую плотность.
- Плотность жидкости определяет, будет ли она плавать или тонуть в другой жидкости.
- Жидкость будет плавать, если ее плотность меньше плотности жидкости, в которую она помещена.
- Жидкость утонет, если ее плотность больше, чем у жидкости, в которую она помещена.
Резюме
Учащиеся наблюдают за тремя бытовыми жидкостями, сложенными друг на друга, и делают вывод, что их плотность должна быть разной. Они будут предсказывать относительную плотность жидкостей, а затем измерять их объем и массу, чтобы увидеть, соответствуют ли их расчеты их наблюдениям и прогнозам.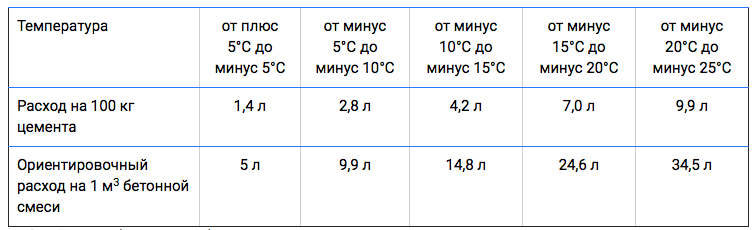
Цель
Учащиеся смогут определить, будет ли жидкость тонуть или плавать в воде, сравнивая ее плотность с плотностью воды.
Оценка
Загрузите лист с заданиями учащегося и раздайте по одному учащемуся, если это указано в задании. Рабочий лист будет служить компонентом «Оценить» каждого плана урока 5-E.
Безопасность
Убедитесь, что вы и ваши ученики носите правильно подобранные очки. При использовании изопропилового спирта прочитайте и соблюдайте все предупреждения на этикетке. Изопропиловый спирт легко воспламеняется. Держите его подальше от источников пламени или искр.
Материалы для каждой группы
- Весы
- Спирт изопропиловый, 70% или более
- Вода
- Градуированный цилиндр
- 2 одинаковых высоких прозрачных пластиковых стакана
- 2 чайные свечи
Материалы для демонстрации
- Весы
- Спирт изопропиловый, 70% или более
- Вода
- Градуированный цилиндр
- 2 одинаковых высоких прозрачных пластиковых стакана
- 2 чайные свечи
Примечания о материалах
Изопропиловый спирт
Демонстрации и упражнения лучше всего работают с 91% раствором изопропилового спирта, который можно приобрести во многих продуктовых магазинах и аптеках.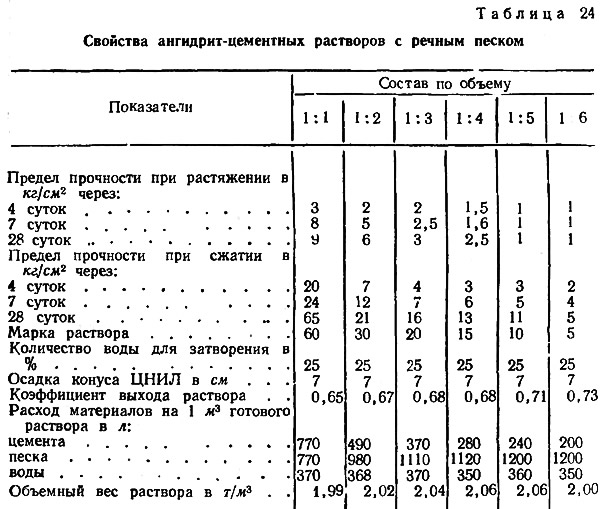 Если вы не можете найти 91-процентное решение, 70-процентное сработает, но ваша свеча может в нем не утонуть. Если это произойдет, не делайте эту демонстрацию. Хотя раствор изопропилового спирта состоит из 91 % спирта и 9 % воды, в рамках данного урока вы можете не принимать во внимание небольшое количество воды.
Если вы не можете найти 91-процентное решение, 70-процентное сработает, но ваша свеча может в нем не утонуть. Если это произойдет, не делайте эту демонстрацию. Хотя раствор изопропилового спирта состоит из 91 % спирта и 9 % воды, в рамках данного урока вы можете не принимать во внимание небольшое количество воды.
Весы
Для второй демонстрации нужны простые весы. Одним из самых дешевых является весы Delta Education Primary Balance (21 дюйм), номер продукта WW020-0452 (21 дюйм). Учащиеся могут использовать уменьшенную версию тех же весов Delta Education, Primary Balance (12 дюймов), номер продукта WW020-0452.
Как рассчитать плотность твердых тел и жидкостей — видео и стенограмма урока
Расчет плотности твердых тел или жидкостей
Когда вас попросят рассчитать плотность, вам нужно использовать комбинацию уравнения плотности, которое мы уже представили, и понимание объема. Например, вам может не быть дан фактический объем материала или объекта, который нужно ввести в уравнение плотности. Вместо этого вам могут дать размеры объекта, и ожидается, что вы сами определите объем.
Вместо этого вам могут дать размеры объекта, и ожидается, что вы сами определите объем.
Объем куба или параллелепипеда равен длине, умноженной на ширину, умноженной на высоту ( Д * Ш * В ). Поэтому, если бы вам нужно было вычислить плотность куба, вы бы сначала измерили длину одной из сторон. Допустим, длина нашего куба получилась 3 метра. Сначала вам нужно рассчитать объем, умножив 3 на 3 на 3 ( V = 3 * 3 * 3). Вам также нужно будет поставить куб на весы, чтобы измерить его массу. Наконец, вы должны разделить свой объем на массу, чтобы получить плотность куба ( p = m/v ).
Но что, если материал не твердый? А если это жидкость?
Измерение объема жидкости не так очевидно, потому что жидкости меняют форму. Когда вы отмеряете жидкости в мерном кувшине, цифры сбоку — это такие вещи, как жидкие унции, пинты и литры (или миллилитры). Литры используются в научном оборудовании, потому что это стандартные научные единицы. И есть очень веская причина, по которой мы используем литры. Объем измеряется в кубических метрах, а 1 кубический метр равен 1000 литрам.Таким образом, преобразование очень просто. (Также обратите внимание, что 1 литр равен 1000 миллилитров).
Объем измеряется в кубических метрах, а 1 кубический метр равен 1000 литрам.Таким образом, преобразование очень просто. (Также обратите внимание, что 1 литр равен 1000 миллилитров).
Подводя итог, вот шаги для расчета плотности твердого тела или жидкости:
1. Вычислите объем, либо измерив размеры твердого тела, либо используя мерный кувшин для жидкости. Преобразуйте любые единицы по мере необходимости, чтобы получить число в метрах в кубе.
2. Положите предмет или материал на весы и определите его массу.
3. Разделите массу на объем, чтобы вычислить плотность ( p = m/v ).
Пример проблемы
Хорошо, давайте рассмотрим пример. Твой лучший друг очень любит молоко, и однажды тебе становится любопытно. Вам интересно, какова плотность молока, которое он пьет. Ваш друг позволяет вам одолжить его стакан молока, чтобы понять это. Вы наливаете молоко в мерный кувшин и обнаруживаете, что у него 150 миллилитров молока. Потом ставишь на весы. Масса стакана и молока вместе 0,115 кг, а масса стакана сама по себе 0,1 кг. Какова плотность молока?
Масса стакана и молока вместе 0,115 кг, а масса стакана сама по себе 0,1 кг. Какова плотность молока?
Прежде всего, мы должны записать то, что мы знаем.
- Объем молока Vmilk 150 мл.
- Масса стакана и молока mglass&milk 0,115 кг.
- А масса самого стакана 0,1 кг.
Мы знаем, что плотность равна массе, деленной на объем ( p = m/v ), поэтому нам нужно вычислить массу молока в килограммах и объем молока в кубических метрах.
Прежде чем мы подставим числа в уравнение, нам нужно сделать некоторые отдельные вычисления.
Прежде всего, какова масса молока? Итак, масса стакана и молока вместе 0,115, а масса стакана сама по себе 0,1, значит, масса молока должна быть (0,115 — 0,1), что равно 0,015 килограмма. Теперь у нас есть масса.
Далее нам нужен объем в кубических метрах. Мы знаем, что объем молока составляет 150 миллилитров, поэтому нам просто нужно преобразовать его в метры в кубе. В литре 1000 миллилитров, поэтому 150 мл равны 0,15 литра (150/1000 = 0. 15). Вы просто делите на 1000. А в метре в кубе 1000 литров, поэтому, чтобы получить наше число в метрах в кубе, нужно снова разделить на 1000. Это дает нам 0,00015 метра в кубе (0,15/1000 = 0,00015). И это наш объем.
15). Вы просто делите на 1000. А в метре в кубе 1000 литров, поэтому, чтобы получить наше число в метрах в кубе, нужно снова разделить на 1000. Это дает нам 0,00015 метра в кубе (0,15/1000 = 0,00015). И это наш объем.
Теперь у нас есть объем молока в кубических метрах и масса молока в килограммах. Подставьте их в уравнение плотности: 0,015 кг, деленное на 0,00015 кубического метра, дает нам плотность 100 кг на кубический метр (0,015 / 0,00015 = 100). Вот и все; это наш ответ.
Резюме урока
Плотность — это мера того, насколько компактна масса вещества или объекта. Плотность предмета или вещества можно рассчитать по такому уравнению: плотность в килограммах на метр в кубе равна массе в килограммах, деленной на объем в метрах в кубе ( p = m/v ).
Вот шаги для расчета плотности твердого тела или жидкости:
1. Определите объем, измерив размеры твердого тела или используя мерный кувшин для жидкости.Преобразуйте любые единицы по мере необходимости, чтобы получить число в метрах в кубе.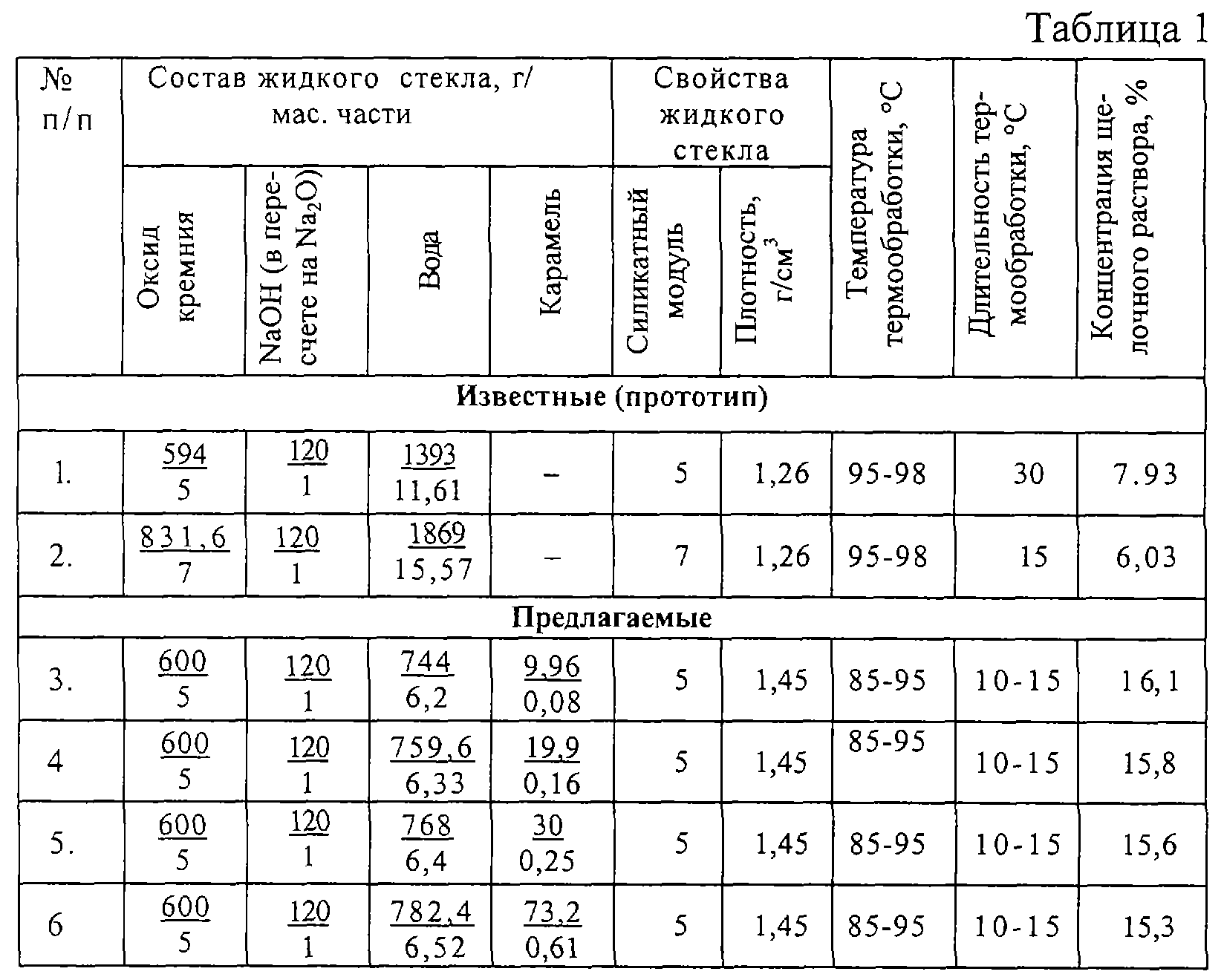
2. Положите предмет или материал на весы, чтобы определить его массу.
3. Разделите массу на объем, чтобы вычислить плотность ( p = m/v ).
Вам также может понадобиться знать, как вычислить объем твердого тела. Например, для куба объем равен длине, умноженной на ширину, умноженной на высоту ( V = L * W * H ). И вам нужно знать некоторые преобразования.Например, 1000 литров — это 1 метр в кубе, а 1000 миллилитров — это 1 литр.
Результаты обучения
После этого урока вы должны уметь:
- Определять плотность
- Объясните, как рассчитать плотность твердого тела или жидкости
Плотность (удельный вес) – обзор
Удельный вес (SG)
Удельный вес определяется как отношение плотности материала к плотности воды при 23°C. SG относится к мере отношения массы данного объема материала при 23°C к массе такого же объема воды при 23°C (Sippel, 1958).Удельный вес материала можно рассчитать по следующему уравнению:
Удельный вес = Плотность (при 23°C)/0,99756 (г/см3)
Метод испытания удельного веса для пластиковых систем соответствует ASTM D792 и ISO 1183. Удельный вес пластика составляет меньше по сравнению с другими материалами влияет на его цену; таким образом, все пластиковые материалы продаются по цене за вес. Одним из наиболее существенных преимуществ, которые обеспечивает выбор пластикового материала, является то, что они легче по сравнению с их металлическими аналогами, что, в свою очередь, снижает общую стоимость продукта.Были разработаны две основные стратегии для измерения SG пластика на основе форм-фактора: метод A используется для стержней, формованных изделий и листов, а метод B — для гранул, хлопьев и порошков. SG, являющийся безразмерной величиной, может быть преобразован в плотность (г/см3), умножив ее на SG воды, 0,99756.
Удельный вес пластика составляет меньше по сравнению с другими материалами влияет на его цену; таким образом, все пластиковые материалы продаются по цене за вес. Одним из наиболее существенных преимуществ, которые обеспечивает выбор пластикового материала, является то, что они легче по сравнению с их металлическими аналогами, что, в свою очередь, снижает общую стоимость продукта.Были разработаны две основные стратегии для измерения SG пластика на основе форм-фактора: метод A используется для стержней, формованных изделий и листов, а метод B — для гранул, хлопьев и порошков. SG, являющийся безразмерной величиной, может быть преобразован в плотность (г/см3), умножив ее на SG воды, 0,99756.
SG/плотность пластика обычно зависит от молекулярного расположения и способа упаковки. Как правило, аморфные полимеры, состоящие только из углеводородов, представляют собой «более легкие» атомы, поэтому их удельный вес равен 0.9–1.1, например, полиэтилен, полипропилен, полистирол и т. д. Полимер, состоящий из «более крупных» атомов, таких как хлор, фтор и т. д., имеет больший удельный вес более 1,4, включая такие полимеры, как поливинилхлорид, политетрафторэтилен (ПТФЭ) и т. д. Кроме того, чем выше упаковка молекулярной цепи, тем больше будет SG, поскольку доступный свободный объем будет меньше, поэтому кристаллические пластики, такие как ПТФЭ (2.2) и поливинилиденхлорид (1.7), имеют более высокие СГ. Таким образом, если пластик может кристаллизоваться, упаковка цепи будет намного эффективнее, и можно будет достичь более высокой плотности (Gilbert, 2017).Другим фактором, влияющим на SG, является степень ветвления. Если пластик имеет большее молекулярное разветвление, полимерная цепь не может плотно упаковываться друг в друга, поэтому свободный объем будет больше, что приведет к уменьшению SG. Этот случай в основном наблюдается для полиэтиленов. Полиэтилен, полученный методом низкого давления, будет иметь высокий удельный вес (0,92–0,94), поскольку разветвление минимально, тогда как полиэтилен, полученный методом высокого давления, имеет низкий удельный вес (0,92–0,94), поскольку они обладают более высокой степенью разветвления.
д., имеет больший удельный вес более 1,4, включая такие полимеры, как поливинилхлорид, политетрафторэтилен (ПТФЭ) и т. д. Кроме того, чем выше упаковка молекулярной цепи, тем больше будет SG, поскольку доступный свободный объем будет меньше, поэтому кристаллические пластики, такие как ПТФЭ (2.2) и поливинилиденхлорид (1.7), имеют более высокие СГ. Таким образом, если пластик может кристаллизоваться, упаковка цепи будет намного эффективнее, и можно будет достичь более высокой плотности (Gilbert, 2017).Другим фактором, влияющим на SG, является степень ветвления. Если пластик имеет большее молекулярное разветвление, полимерная цепь не может плотно упаковываться друг в друга, поэтому свободный объем будет больше, что приведет к уменьшению SG. Этот случай в основном наблюдается для полиэтиленов. Полиэтилен, полученный методом низкого давления, будет иметь высокий удельный вес (0,92–0,94), поскольку разветвление минимально, тогда как полиэтилен, полученный методом высокого давления, имеет низкий удельный вес (0,92–0,94), поскольку они обладают более высокой степенью разветвления.
Аварийная дезинфекция питьевой воды
В чрезвычайной ситуации, когда регулярная подача воды была прервана — например, ураган, наводнение или поломка водопровода — местные власти могут рекомендовать использовать только воду в бутылках, кипяченую или дезинфицированную воду до тех пор, пока не будет восстановлена регулярная подача воды.В приведенных ниже инструкциях показано, как кипятить и дезинфицировать воду, чтобы убить большинство болезнетворных микроорганизмов, которые могут присутствовать в воде. Однако кипячение или дезинфекция не уничтожит другие загрязняющие вещества, такие как тяжелые металлы, соли и большинство других химических веществ.
Распечатать документ «Экстренная дезинфекция питьевой воды».
ИСПОЛЬЗУЙТЕ ТОЛЬКО ТОЛЬКО ДЕЗИНФЕКЦИОННУЮ ВОДУ ДЛЯ ПИТЬЯ, ПРИГОТОВЛЕНИЯ ЛЮБОГО ПРИГОТОВЛЕННОГО НАПИТКА, МЫТЬЯ ПОСУДЫ И ЧИСТКИ ЗУБОВ.
- Используйте бутилированную воду или правильно подготовленную и хранящуюся воду в качестве аварийного запаса воды.

- Вскипятите воду , если у вас нет бутилированной воды. Кипячения достаточно для уничтожения патогенных бактерий, вирусов и простейших (ВОЗ, 2015).
- Если вода мутная, дайте ей отстояться и профильтруйте ее через чистую ткань, бумажное полотенце или кофейный фильтр.
- Доведите воду до кипения в течение не менее одной минуты.На высоте более 5000 футов (1000 метров) кипятите воду в течение трех минут.
- Дайте воде остыть естественным образом и храните ее в чистых контейнерах с крышками.
- Чтобы улучшить пресный вкус кипяченой воды, добавьте одну щепотку соли на каждый литр или литр воды или несколько раз перелейте воду из одной чистой емкости в другую.
- Дезинфицируйте воду с помощью бытового отбеливателя , если вы не можете вскипятить воду. Используйте только обычные хлорные отбеливатели без запаха, которые подходят для дезинфекции и санитарной обработки, как указано на этикетке.
 На этикетке может быть указано, что действующее вещество содержит 6 или 8,25% гипохлорита натрия. Не используйте ароматизированные, безопасные для цвета или отбеливатели с добавлением чистящих средств. Если вода мутная, дайте ей отстояться и профильтруйте ее через чистую ткань, бумажное полотенце или кофейный фильтр.
На этикетке может быть указано, что действующее вещество содержит 6 или 8,25% гипохлорита натрия. Не используйте ароматизированные, безопасные для цвета или отбеливатели с добавлением чистящих средств. Если вода мутная, дайте ей отстояться и профильтруйте ее через чистую ткань, бумажное полотенце или кофейный фильтр.- Найдите чистую пипетку в аптечке или в наборе для неотложной помощи.
- Найдите свежий жидкий хлорный отбеливатель или жидкий хлорный отбеливатель, который хранится при комнатной температуре менее одного года.
- Используйте приведенную ниже таблицу в качестве руководства для определения количества отбеливателя, которое следует добавить в воду, например, 8 капель 6% отбеливателя или 6 капель 8.25% отбеливателя на каждый галлон воды. Удвойте количество отбеливателя, если вода мутная, цветная или очень холодная.
- Перемешать и дать постоять 30 минут. Вода должна иметь легкий запах хлора. Если это не так, повторите дозировку и дайте постоять еще 15 минут перед использованием.

- Если вкус хлора слишком сильный, перелейте воду из одной чистой емкости в другую и дайте ей отстояться в течение нескольких часов перед использованием.
| Объем воды | Количество 6% отбеливателя для добавления* | Количество 8.25% отбеливателя для добавления* |
|---|---|---|
| 1 кварта/литр | 2 капли | 2 капли |
| 1 галлон | 8 капель | 6 капель |
| 2 галлона | 16 капель (1/4 чайной ложки) | 12 капель (1/8 чайной ложки) |
| 4 галлона | 1/3 чайной ложки | 1/4 чайной ложки |
| 8 галлонов | 2/3 чайной ложки | 1/2 чайной ложки |
*Отбеливатель может содержать 6 или 8 штук.25% гипохлорит натрия.
Дополнительные водные ориентиры
- Подготовить и хранить аварийный запас воды.
 Посетите веб-сайт Федерального агентства по чрезвычайным ситуациям (FEMA) для получения дополнительных инструкций по подготовке и хранению аварийного запаса воды.
Посетите веб-сайт Федерального агентства по чрезвычайным ситуациям (FEMA) для получения дополнительных инструкций по подготовке и хранению аварийного запаса воды. - Поищите другие источники воды в вашем доме и рядом с ним. Хотя бутилированная вода — ваш лучший выбор, вы можете найти другие источники воды, растопив кубики льда или опустошив бак или трубы с горячей водой.Также можно использовать речную или озерную воду. Обычно лучше использовать проточную воду, чем стоячую. Однако не используйте воду с плавающим веществом или воду темного цвета или сомнительного запаха. Независимо от источника, обрабатывайте воду, следуя инструкциям на главной странице выше. Если на вашем участке есть затопленный колодец, обязательно продезинфицируйте и проверьте воду из колодца после затопления. Обратитесь за консультацией в департамент здравоохранения штата или в местный отдел или ознакомьтесь с нашим документом «Что делать с вашим частным колодцем после наводнения».

- Подумайте, как выглядит вода и как ее фильтровать при необходимости. Дезинфекция не работает, если вода мутная или окрашена. Если вода мутная, дайте ей отстояться. Затем профильтруйте воду через чистую ткань, бумажное полотенце или кофейный фильтр. Храните отстоянную и фильтрованную воду в чистых емкостях с крышками.
Другие методы дезинфекции
Если у вас нет жидкого отбеливателя, вы можете использовать один из других методов дезинфекции, описанных ниже.
- Гранулированный гипохлорит кальция. Первый шаг — приготовить раствор хлора, который вы будете использовать для дезинфекции воды. В целях безопасности делайте это в проветриваемом помещении и наденьте защитные очки. Добавьте одну чайную ложку с горкой (приблизительно ¼ унции) гранулированного гипохлорита кальция (HTH) с высоким содержанием тестов на два галлона воды и перемешайте, пока частицы не растворятся. Смесь будет производить раствор хлора примерно 500 миллиграммов на литр.
 Для дезинфекции воды добавьте одну часть раствора хлора на каждые 100 частей обрабатываемой воды.Это примерно то же самое, что добавить 1 пинту (16 унций) раствора хлора на 12,5 галлонов воды. Если вкус хлора слишком силен, перелейте воду из одной чистой емкости в другую и дайте ей отстояться в течение нескольких часов перед использованием. ОСТОРОЖНО: HTH является очень сильным окислителем. Следуйте инструкциям на этикетке для безопасного обращения с этим химическим веществом и его хранения.
Для дезинфекции воды добавьте одну часть раствора хлора на каждые 100 частей обрабатываемой воды.Это примерно то же самое, что добавить 1 пинту (16 унций) раствора хлора на 12,5 галлонов воды. Если вкус хлора слишком силен, перелейте воду из одной чистой емкости в другую и дайте ей отстояться в течение нескольких часов перед использованием. ОСТОРОЖНО: HTH является очень сильным окислителем. Следуйте инструкциям на этикетке для безопасного обращения с этим химическим веществом и его хранения. - Йод обыкновенный бытовой (или «настойка йода»). В вашей аптечке или аптечке может быть йод.Добавьте пять капель 2%-ной настойки йода на каждый литр или литр воды, которую вы дезинфицируете. Если вода мутная или окрашенная, добавьте 10 капель йода. Перемешайте и дайте воде отстояться не менее 30 минут перед использованием.
- Таблетки для дезинфекции воды. Вы можете дезинфицировать воду таблетками, содержащими хлор, йод, диоксид хлора или другие дезинфицирующие средства.
 Эти таблетки доступны в Интернете или в аптеках и магазинах спортивных товаров. Следуйте инструкциям на этикетке продукта, так как каждый продукт может иметь различную силу действия.
Эти таблетки доступны в Интернете или в аптеках и магазинах спортивных товаров. Следуйте инструкциям на этикетке продукта, так как каждый продукт может иметь различную силу действия.
Дополнительная информация
Учебное пособие по физике
На предыдущей странице мы узнали, что тепло делает с объектом, когда оно получено или высвобождено. Притоки или потери тепла приводят к изменениям температуры, изменениям состояния или производительности труда. Тепло – это передача энергии. Когда объект получает или теряет, в этом объекте будут происходить соответствующие энергетические изменения. Изменение температуры связано с изменением средней кинетической энергии частиц внутри объекта.Изменение состояния связано с изменением внутренней потенциальной энергии, которой обладает объект. И когда работа выполнена, происходит общая передача энергии объекту, над которым выполняется работа. В этой части Урока 2 мы исследуем вопрос . Как можно измерить количество теплоты, полученное или выделенное объектом?
Удельная теплоемкость
Предположим, что несколько предметов, состоящих из разных материалов, нагреваются одинаковым образом. Будут ли объекты нагреваться с одинаковой скоростью? Ответ: скорее всего нет. Различные материалы будут нагреваться с разной скоростью, потому что каждый материал имеет свою удельную теплоемкость. Под удельной теплоемкостью понимается количество теплоты, необходимое для того, чтобы заставить единицу массы (скажем, грамм или килограмм) изменить свою температуру на 1°C. Удельная теплоемкость различных материалов часто приводится в учебниках. Стандартными метрическими единицами являются Джоули/килограмм/Кельвин (Дж/кг/К). Чаще используются единицы измерения Дж/г/°C.Используйте виджет ниже для просмотра удельной теплоемкости различных материалов. Просто введите название вещества (алюминий, железо, медь, вода, метанол, дерево и т. д.) и нажмите кнопку «Отправить»; результаты будут отображаться в отдельном окне.
Будут ли объекты нагреваться с одинаковой скоростью? Ответ: скорее всего нет. Различные материалы будут нагреваться с разной скоростью, потому что каждый материал имеет свою удельную теплоемкость. Под удельной теплоемкостью понимается количество теплоты, необходимое для того, чтобы заставить единицу массы (скажем, грамм или килограмм) изменить свою температуру на 1°C. Удельная теплоемкость различных материалов часто приводится в учебниках. Стандартными метрическими единицами являются Джоули/килограмм/Кельвин (Дж/кг/К). Чаще используются единицы измерения Дж/г/°C.Используйте виджет ниже для просмотра удельной теплоемкости различных материалов. Просто введите название вещества (алюминий, железо, медь, вода, метанол, дерево и т. д.) и нажмите кнопку «Отправить»; результаты будут отображаться в отдельном окне.
Удельная теплоемкость твердого алюминия (0,904 Дж/г/°C) отличается от удельной теплоемкости твердого железа (0,449 Дж/г/°C). Это означает, что для повышения температуры данной массы алюминия на 1°С потребуется больше тепла, чем для повышения температуры той же массы железа на 1°С. Фактически, для повышения температуры образца алюминия на заданное количество потребовалось бы примерно в два раза больше тепла, чем для того же изменения температуры того же количества железа. Это связано с тем, что удельная теплоемкость алюминия почти в два раза выше, чем у железа.
Фактически, для повышения температуры образца алюминия на заданное количество потребовалось бы примерно в два раза больше тепла, чем для того же изменения температуры того же количества железа. Это связано с тем, что удельная теплоемкость алюминия почти в два раза выше, чем у железа.
Теплоемкость указана на основе на грамм или на килограмм . Иногда значение указывается на основе на моль , и в этом случае оно называется молярной теплоемкостью. Тот факт, что они перечислены на основе на количество , указывает на то, что количество тепла, необходимое для повышения температуры вещества, зависит от количества вещества.Всякий человек, который кипятил на плите кастрюлю с водой, несомненно, знает эту истину. Вода кипит при 100°С на уровне моря и при несколько более низких температурах на возвышенностях. Чтобы довести кастрюлю с водой до кипения, ее температуру нужно сначала поднять до 100°C. Это изменение температуры достигается за счет поглощения тепла от горелки печи. Нетрудно заметить, что для доведения до кипения полной кастрюли воды требуется значительно больше времени, чем для доведения до кипения половины воды. Это связано с тем, что полная кастрюля с водой должна поглощать больше тепла, чтобы привести к такому же изменению температуры.На самом деле, требуется вдвое больше тепла, чтобы вызвать такое же изменение температуры в удвоенной массе воды.
Нетрудно заметить, что для доведения до кипения полной кастрюли воды требуется значительно больше времени, чем для доведения до кипения половины воды. Это связано с тем, что полная кастрюля с водой должна поглощать больше тепла, чтобы привести к такому же изменению температуры.На самом деле, требуется вдвое больше тепла, чтобы вызвать такое же изменение температуры в удвоенной массе воды.
Удельная теплоемкость также указана на основе на K или на °C . Тот факт, что удельная теплоемкость указана на основе на градус , указывает на то, что количество теплоты, необходимое для нагревания данной массы вещества до определенной температуры, зависит от изменения температуры, необходимого для достижения этой конечной температуры.Другими словами, важна не конечная температура, а общее изменение температуры. Для изменения температуры воды с 20°С до 100°С (изменение на 80°С) требуется больше тепла, чем для повышения температуры того же количества воды с 60°С до 100°С (изменение на 40°С). °С). Фактически, для изменения температуры данной массы воды на 80°С требуется в два раза больше тепла, чем для изменения на 40°С. Человек, который хочет быстрее довести воду до кипения на плите, должен начать с теплой водопроводной воды, а не с холодной.
°С). Фактически, для изменения температуры данной массы воды на 80°С требуется в два раза больше тепла, чем для изменения на 40°С. Человек, который хочет быстрее довести воду до кипения на плите, должен начать с теплой водопроводной воды, а не с холодной.
Это обсуждение удельной теплоемкости заслуживает одного заключительного комментария. Термин «удельная теплоемкость» является чем-то вроде неправильного употребления . Термин подразумевает, что вещества могут иметь способность содержать вещь , называемую теплотой. Как обсуждалось ранее, тепло не является чем-то, что содержится в объекте. Тепло — это то, что передается объекту или от него. Объекты содержат энергию в различных формах. Когда эта энергия передается другим объектам с другой температурой, мы называем переданную энергию теплом или тепловой энергией .Хотя это вряд ли приживется, более подходящим термином будет удельная энергетическая емкость.
Связь количества тепла с изменением температуры
Удельная теплоемкость обеспечивает средство математической зависимости количества тепловой энергии, полученной (или потерянной) образцом любого вещества, от массы образца и его результирующего изменения температуры. Связь между этими четырьмя величинами часто выражается следующим уравнением.
Связь между этими четырьмя величинами часто выражается следующим уравнением.
Q = м•C•ΔT
, где Q — количество тепла, переданного объекту или от него, m — масса объекта, C — удельная теплоемкость материала, из которого состоит объект, а ΔT — результирующее изменение температуры объекта. Как и во всех ситуациях в науке, значение дельта (∆) для любой величины рассчитывается путем вычитания начального значения величины из конечного значения величины. В этом случае ΔT равно T конечный — T начальный .При использовании приведенного выше уравнения значение Q может оказаться как положительным, так и отрицательным. Как всегда, положительный и отрицательный результат расчета имеет физическое значение. Положительное значение Q указывает на то, что объект получил тепловую энергию из своего окружения; это будет соответствовать повышению температуры и положительному значению ΔT. Отрицательное значение Q указывает на то, что объект выделяет тепловую энергию в окружающую среду; это будет соответствовать снижению температуры и отрицательному значению ΔT.
Знание любых трех из этих четырех величин позволяет вычислить четвертую величину. Распространенной задачей на многих уроках физики является решение задач, связанных с соотношениями между этими четырьмя величинами. В качестве примеров рассмотрим две задачи ниже. Решение каждой проблемы разработано для вас. Дополнительную практику можно найти в разделе «Проверьте свое понимание» внизу страницы.
Пример задачи 1 |
Как и любая задача в физике, решение начинается с определения известных величин и связывания их с символами, используемыми в соответствующем уравнении. В этой задаче мы знаем следующее:
м = 450 г
С = 4,18 Дж/г/°С
T исходная = 15°C
Т окончательная = 85°С
Мы хотим определить значение Q — количество теплоты. Для этого воспользуемся уравнением Q = m•C•ΔT. m и C известны; ΔT можно определить по начальной и конечной температурам.
Для этого воспользуемся уравнением Q = m•C•ΔT. m и C известны; ΔT можно определить по начальной и конечной температурам.
T = T окончательная — T начальная = 85°C — 15°C = 70°C
Зная три из четырех величин соответствующего уравнения, мы можем подставить и решить Q.
Q = м•C•ΔT = (450 г)•(4,18 Дж/г/°C)•(70°C)
Q = 131670 Дж
Q = 1.3×10 5 Дж = 130 кДж (округлено до двух значащих цифр)
Пример задачи 2 |
По сравнению с предыдущей задачей, это гораздо более сложная задача. На самом деле эта проблема как две проблемы в одной. В основе стратегии решения проблем лежит признание того, что количество тепла, потерянного водой (Q вода ), равно количеству тепла, полученному металлом (Q металл ). Поскольку значения m, C и ΔT воды известны, можно рассчитать Q воды .Это значение воды Q равно значению металла Q . Как только значение Q металл известно, его можно использовать со значением m и ΔT металла для расчета Q металла . Использование этой стратегии приводит к следующему решению:
Часть 1. Определение потерь тепла с водой
Дано:
м = 50,0 г
С = 4,18 Дж/г/°С
T исходная = 88,6°C
Т окончательный = 87.1°С
ΔT = -1,5°C (T окончательная — T исходная )
Решите для Q вода :
Q вода = m•C•ΔT = (50,0 г)•(4,18 Дж/г/°C)•(-1,5°C)
Q вода = -313,5 Дж (не округлено)
(Знак — означает, что вода теряет тепло)
Часть 2: Определение стоимости металла C
Дано:
Q металл = 313.5 Дж (используйте знак +, так как металл нагревается)
m = 12,9 г
T исходная = 26,5°C
Т окончательная = 87,1°С
ΔT = (T окончательный — T начальный )
Решить для металла C :
Переставить Q металл = m металл •C металл •ΔT металл для получения C металл = Q металл / (m металл •1 металл 2) металл 2)
C металл = Q металл / (m металл • ΔT металл ) = (313.
5 Дж)/[(12,9 г)•(60,6°С)]
C металл = 0,40103 Дж/г/°C
C металл = 0,40 Дж/г/°C (округлено до двух значащих цифр)
Нагрев и изменения состояния
Обсуждение выше и сопровождающее уравнение (Q = m•C•∆T) связывают тепло, полученное или потерянное объектом, с результирующими изменениями температуры этого объекта. Как мы узнали, иногда тепло приобретается или теряется, но температура не меняется.Это тот случай, когда вещество претерпевает изменение состояния. Итак, теперь мы должны исследовать математику, связанную с изменениями состояния и количеством теплоты.
Чтобы начать обсуждение, давайте рассмотрим различные изменения состояния, которые можно наблюдать для образца материи. В приведенной ниже таблице перечислены несколько изменений состояния и указаны имена, обычно связанные с каждым процессом.
Процесс | Изменение состояния |
Плавление | Из твердого в жидкое |
Замораживание | Из жидкого в твердое |
Испарение | Из жидкости в газ |
Конденсат | Газ в жидкость |
Сублимация | Твердое тело в газообразное |
Депонирование | Из газа в твердое тело |
В случае плавления, кипения и сублимации к образцу вещества необходимо добавить энергию, чтобы вызвать изменение состояния. Такие изменения состояния называются эндотермическими. Замерзание, конденсация и осаждение экзотермичны; энергия высвобождается образцом материи, когда происходят эти изменения состояния. Таким образом, можно заметить, что образец льда (твердая вода) тает, когда его помещают на горелку или рядом с ней. Тепло передается от горелки к образцу льда; лед получает энергию, вызывая изменение состояния. Но сколько энергии потребуется, чтобы вызвать такое изменение состояния? Существует ли математическая формула, которая могла бы помочь в определении ответа на этот вопрос? Наверняка есть.
Такие изменения состояния называются эндотермическими. Замерзание, конденсация и осаждение экзотермичны; энергия высвобождается образцом материи, когда происходят эти изменения состояния. Таким образом, можно заметить, что образец льда (твердая вода) тает, когда его помещают на горелку или рядом с ней. Тепло передается от горелки к образцу льда; лед получает энергию, вызывая изменение состояния. Но сколько энергии потребуется, чтобы вызвать такое изменение состояния? Существует ли математическая формула, которая могла бы помочь в определении ответа на этот вопрос? Наверняка есть.
Количество энергии, необходимое для изменения состояния образца материи, зависит от трех факторов. Это зависит от того, что представляет собой вещество, от того, насколько вещество претерпевает изменение состояния и от того, какое изменение состояния происходит. Например, для плавления льда (твердой воды) требуется разное количество энергии по сравнению с плавлением железа. И для таяния льда (твердой воды) требуется разное количество энергии, чем для испарения того же количества жидкой воды. И, наконец, для плавления 10 требуется разное количество энергии.0 граммов льда по сравнению с таянием 100,0 граммов льда. Вещество, процесс и количество вещества — это три переменные, влияющие на количество энергии, необходимое для того, чтобы вызвать конкретное изменение состояния. Используйте виджет ниже, чтобы исследовать влияние вещества и процесса на изменение энергии. (Обратите внимание, что теплота плавления — это изменение энергии, связанное с изменением состояния твердого и жидкого состояния.)
И, наконец, для плавления 10 требуется разное количество энергии.0 граммов льда по сравнению с таянием 100,0 граммов льда. Вещество, процесс и количество вещества — это три переменные, влияющие на количество энергии, необходимое для того, чтобы вызвать конкретное изменение состояния. Используйте виджет ниже, чтобы исследовать влияние вещества и процесса на изменение энергии. (Обратите внимание, что теплота плавления — это изменение энергии, связанное с изменением состояния твердого и жидкого состояния.)
Значения удельной теплоты плавления и удельной теплоты парообразования приведены на основе на количество .Например, удельная теплота плавления воды равна 333 Дж/г. Чтобы растопить 1 г льда, требуется 333 Дж энергии. Чтобы растопить 10,0 г льда, требуется в 10 раз больше энергии — 3330 Дж. Рассуждения таким образом приводят к следующим формулам, связывающим количество теплоты с массой вещества и теплотой плавления и парообразования.
Для плавления и замораживания: Q = m•ΔH плавление
Для испарения и конденсации: Q = m•ΔH испарение
, где Q представляет собой количество энергии, полученной или высвобожденной во время процесса, m представляет собой массу образца, ΔH плавления представляет собой удельную теплоту плавления (в расчете на грамм), а ΔH парообразования представляет собой удельную теплоту плавления испарения (в пересчете на грамм). Подобно обсуждению Q = m•C•ΔT, значения Q могут быть как положительными, так и отрицательными. Значения Q положительны для процесса плавления и парообразования; это согласуется с тем фактом, что образец вещества должен получить энергию, чтобы расплавиться или испариться. Значения Q отрицательны для процессов замерзания и конденсации; это согласуется с тем фактом, что образец вещества должен терять энергию, чтобы замерзнуть или сконденсироваться.
Подобно обсуждению Q = m•C•ΔT, значения Q могут быть как положительными, так и отрицательными. Значения Q положительны для процесса плавления и парообразования; это согласуется с тем фактом, что образец вещества должен получить энергию, чтобы расплавиться или испариться. Значения Q отрицательны для процессов замерзания и конденсации; это согласуется с тем фактом, что образец вещества должен терять энергию, чтобы замерзнуть или сконденсироваться.
В качестве иллюстрации того, как можно использовать эти уравнения, рассмотрим следующие два примера задач.
Пример задачи 3 |
Уравнение, связывающее массу (48,2 г), теплоту плавления (333 Дж/г) и количество энергии (Q), имеет вид Q = m•ΔH плавление . Подстановка известных значений в уравнение приводит к ответу.
Подстановка известных значений в уравнение приводит к ответу.
Q = м•ΔH плавление = (48,2 г)•(333 Дж/г)
Q = 16050,6 Дж
Q = 1,61 x 10 4 Дж = 16,1 кДж (округлено до трех значащих цифр)
Пример Задача 3 включает в себя довольно простой расчет типа «подключи и пыхни». Теперь мы попробуем решить примерную проблему 4, которая потребует значительно более глубокого анализа.
Пример задачи 4 |
В этой задаче лед тает, а жидкая вода остывает. Энергия передается от жидкости к твердому телу. Чтобы растопить твердый лед, необходимо передать 333 Дж энергии на каждый грамм льда. Эта передача энергии от жидкой воды льду охлаждает жидкость.Но жидкость может охлаждаться только до 0°C — точки замерзания воды. При этой температуре жидкость начнет застывать (замерзать) и лед полностью не растает.
Эта передача энергии от жидкой воды льду охлаждает жидкость.Но жидкость может охлаждаться только до 0°C — точки замерзания воды. При этой температуре жидкость начнет застывать (замерзать) и лед полностью не растает.
Мы знаем о льду и жидкой воде следующее:
Данная информация о льду:
м = 50,0 г
ΔH сплав = 333 Дж/г
Информация о жидкой воде:
С = 4.18 Дж/г/°С
T исходная = 26,5°C
Т окончательная = 0,0°С
ΔT = -26,5°C (T окончательная — T исходная )
Энергия, полученная льдом, равна энергии, потерянной водой.
Q лед = -Q жидкая вода
Знак — указывает на то, что один объект получает энергию, а другой объект теряет энергию. Мы можем вычислить левую часть приведенного выше уравнения следующим образом:
Q лёд = m•ΔH плавление = (50.
0 г)•(333 Дж/г)
Q лед = 16650 Дж
Теперь мы можем положить правую часть уравнения равной m•C•ΔT и начать подставлять известные значения C и ΔT, чтобы найти массу жидкой воды. Решение:
16650 J = -Q жидкая вода
16650 Дж = -m жидкая вода •C жидкая вода •ΔT жидкая вода
16650 Дж = -м жидкая вода •(4.18 Дж/г/°С)•(-26,5°С)
16650 Дж = -м жидкая вода •(-110,77 Дж/°C)
m жидкая вода = -(16650 Дж)/(-110,77 Дж/°C)
м жидкая вода = 150,311 г
м жидкая вода = 1,50×10 2 г (округлено до трех значащих цифр)
Новый взгляд на кривые нагрева и охлаждения
На предыдущей странице Урока 2 обсуждалась кривая нагрева воды.Кривая нагревания показывала, как температура воды повышалась с течением времени при нагревании образца воды в твердом состоянии (т.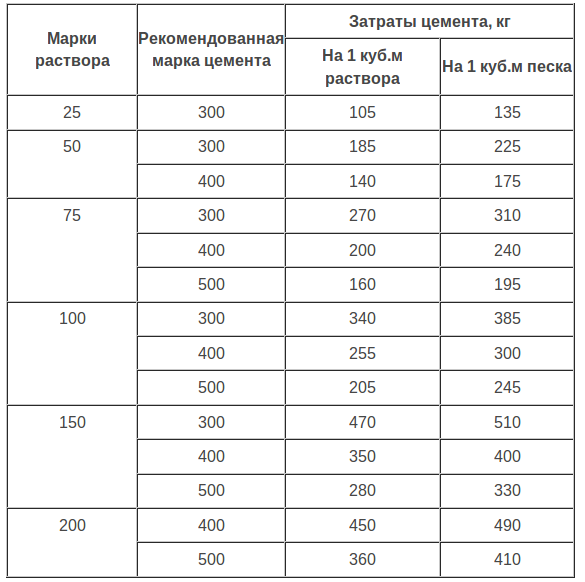 е. льда). Мы узнали, что добавление тепла к образцу воды может вызвать либо изменение температуры, либо изменение состояния. При температуре плавления воды добавление тепла вызывает переход воды из твердого состояния в жидкое состояние. А при температуре кипения воды добавление тепла вызывает переход воды из жидкого состояния в газообразное.Эти изменения состояния происходили без каких-либо изменений температуры. Однако добавление тепла к образцу воды, которая не находится при температуре фазового перехода, приведет к изменению температуры.
е. льда). Мы узнали, что добавление тепла к образцу воды может вызвать либо изменение температуры, либо изменение состояния. При температуре плавления воды добавление тепла вызывает переход воды из твердого состояния в жидкое состояние. А при температуре кипения воды добавление тепла вызывает переход воды из жидкого состояния в газообразное.Эти изменения состояния происходили без каких-либо изменений температуры. Однако добавление тепла к образцу воды, которая не находится при температуре фазового перехода, приведет к изменению температуры.
Теперь мы можем подойти к теме кривых отопления на более количественной основе. На приведенной ниже диаграмме представлена кривая нагрева воды. На линиях графика имеется пять помеченных участков.
Три диагональных участка представляют изменения температуры пробы воды в твердом состоянии (участок 1), жидком состоянии (участок 3) и газообразном состоянии (участок 5).Два горизонтальных участка отображают изменения состояния воды. В секции 2 происходит таяние пробы воды; твердое тело переходит в жидкое. В секции 4 образец воды подвергается кипячению; жидкость переходит в газ. Количество теплоты, переданной воде в секциях 1, 3 и 5, связано с массой образца и изменением температуры по формуле Q = m•C•ΔT. А количество теплоты, переданной воде на участках 2 и 4, связано с массой образца и теплотой плавления и парообразования формулами Q = m•ΔH плавления (участок 2) и Q = m•ΔH вапоризация (раздел 4).Итак, теперь мы попытаемся рассчитать количество теплоты, необходимое для перевода 50,0 граммов воды из твердого состояния при -20,0°С в газообразное состояние при 120,0°С. Для расчета потребуется пять шагов — по одному шагу на каждый участок приведенного выше графика. Поскольку удельная теплоемкость вещества зависит от температуры, в наших расчетах мы будем использовать следующие значения удельной теплоемкости:
В секции 2 происходит таяние пробы воды; твердое тело переходит в жидкое. В секции 4 образец воды подвергается кипячению; жидкость переходит в газ. Количество теплоты, переданной воде в секциях 1, 3 и 5, связано с массой образца и изменением температуры по формуле Q = m•C•ΔT. А количество теплоты, переданной воде на участках 2 и 4, связано с массой образца и теплотой плавления и парообразования формулами Q = m•ΔH плавления (участок 2) и Q = m•ΔH вапоризация (раздел 4).Итак, теперь мы попытаемся рассчитать количество теплоты, необходимое для перевода 50,0 граммов воды из твердого состояния при -20,0°С в газообразное состояние при 120,0°С. Для расчета потребуется пять шагов — по одному шагу на каждый участок приведенного выше графика. Поскольку удельная теплоемкость вещества зависит от температуры, в наших расчетах мы будем использовать следующие значения удельной теплоемкости:
Твердая вода: C=2,00 Дж/г/°C
Жидкая вода: C = 4,18 Дж/г/°C
Газообразная вода: C = 2.01 Дж/г/°С
Наконец, мы будем использовать ранее опубликованные значения ΔH плавления (333 Дж/г) и ΔH испарения (2,23 кДж/г).
Раздел 1 : Изменение температуры твердой воды (льда) с -20,0°C до 0,0°C.
Использовать Q 1 = m•C•ΔT
, где m = 50,0 г, C = 2,00 Дж/г/°C, T начальная = -200°C и T конечная = 0,0°C
Q 1 = m•C•ΔT = (50.0 г)•(2,00 Дж/г/°C)•(0,0°C — -20,0°C)
Q 1 = 2,00 x 10 3 Дж = 2,00 кДж
Секция 2 : Плавление льда при 0,0°C.
Применение Q 2 = m•ΔH сплав
, где m = 50,0 г и ΔH сплава = 333 Дж/г
Q 2 = m•ΔH сплав = (50,0 г)•(333 Дж/г)
Q 2 = 1,665 x 10 4 Дж = 16.65 кДж
Q 2 = 16,7 кДж (округлено до 3 значащих цифр)
Раздел 3 : Изменение температуры жидкой воды с 0,0°C до 100,0°C.
Использование Q 3 = m•C•ΔT
, где m = 50,0 г, C = 4,18 Дж/г/°C, T начальная = 0,0°C и T конечная = 100,0°C
Q 3 = м•C•ΔT = (50,0 г)•(4,18 Дж/г/°C)•(100,0°C — 0,0°C)
Q 3 = 2.09 x 10 4 Дж = 20,9 кДж
Раздел 4 : Кипячение воды при 100,0°C.
Использование Q 4 = m•ΔH испарение
где m = 50,0 г и ΔH испарения = 2,23 кДж/г
Q 4 = м•ΔH испарение = (50,0 г)•(2,23 кДж/г)
Q 4 = 111,5 кДж
Q 4 = 112 кДж (округлено до 3 значащих цифр 12)
Раздел 5 : Изменение температуры жидкой воды от 100. от 0°С до 120,0°С.
от 0°С до 120,0°С.
Использование Q 5 = m•C•ΔT
, где m = 50,0 г, C = 2,01 Дж/г/°C, T начальная = 100,0°C и T конечная = 120,0°C
Q 5 = м•C•ΔT = (50,0 г)•(2,01 Дж/г/°C)•(120,0°C — 100,0°C)
Q 5 = 2,01 x 10 3 Дж = 2,01 кДж
Общее количество тепла, необходимое для превращения твердой воды (льда) при -20°C в газообразную воду при 120°C, представляет собой сумму значений Q для каждого участка графика.То есть
Q всего = Q 1 + Q 2 + Q 3 + Q 4 + Q 5
Суммирование этих пяти значений Q и округление до нужного количества значащих цифр дает значение 154 кДж в качестве ответа на исходный вопрос.
В приведенном выше примере есть несколько особенностей решения, над которыми стоит задуматься:
- Во-первых: длинная задача была разделена на части, каждая из которых представляла одну из пяти секций графа.
 Поскольку вычислялось пять значений Q, они были помечены как Q 1 , Q 2 и т. д. Такой уровень организации требуется в такой многошаговой задаче, как эта.
Поскольку вычислялось пять значений Q, они были помечены как Q 1 , Q 2 и т. д. Такой уровень организации требуется в такой многошаговой задаче, как эта. - Секунда: внимание было обращено на знак +/- на ΔT. Изменение температуры (или любой величины) всегда рассчитывается как конечное значение величины минус начальное значение этой величины.
- Третье: Внимание уделялось юнитам на протяжении всей проблемы.Единицы Q будут либо в джоулях, либо в килоджоулях, в зависимости от того, какие величины умножаются. Пренебрежение вниманием к единицам измерения является распространенной причиной сбоев в подобных задачах.
- Четвертое: внимание уделялось значащим цифрам на протяжении всей задачи. Хотя это никогда не должно становиться основным акцентом любой проблемы в физике, это, безусловно, деталь, на которую стоит обратить внимание.
Здесь, на этой странице, мы узнали, как рассчитать количество тепла, задействованного в любом процессе нагрева/охлаждения и в любом процессе изменения состояния.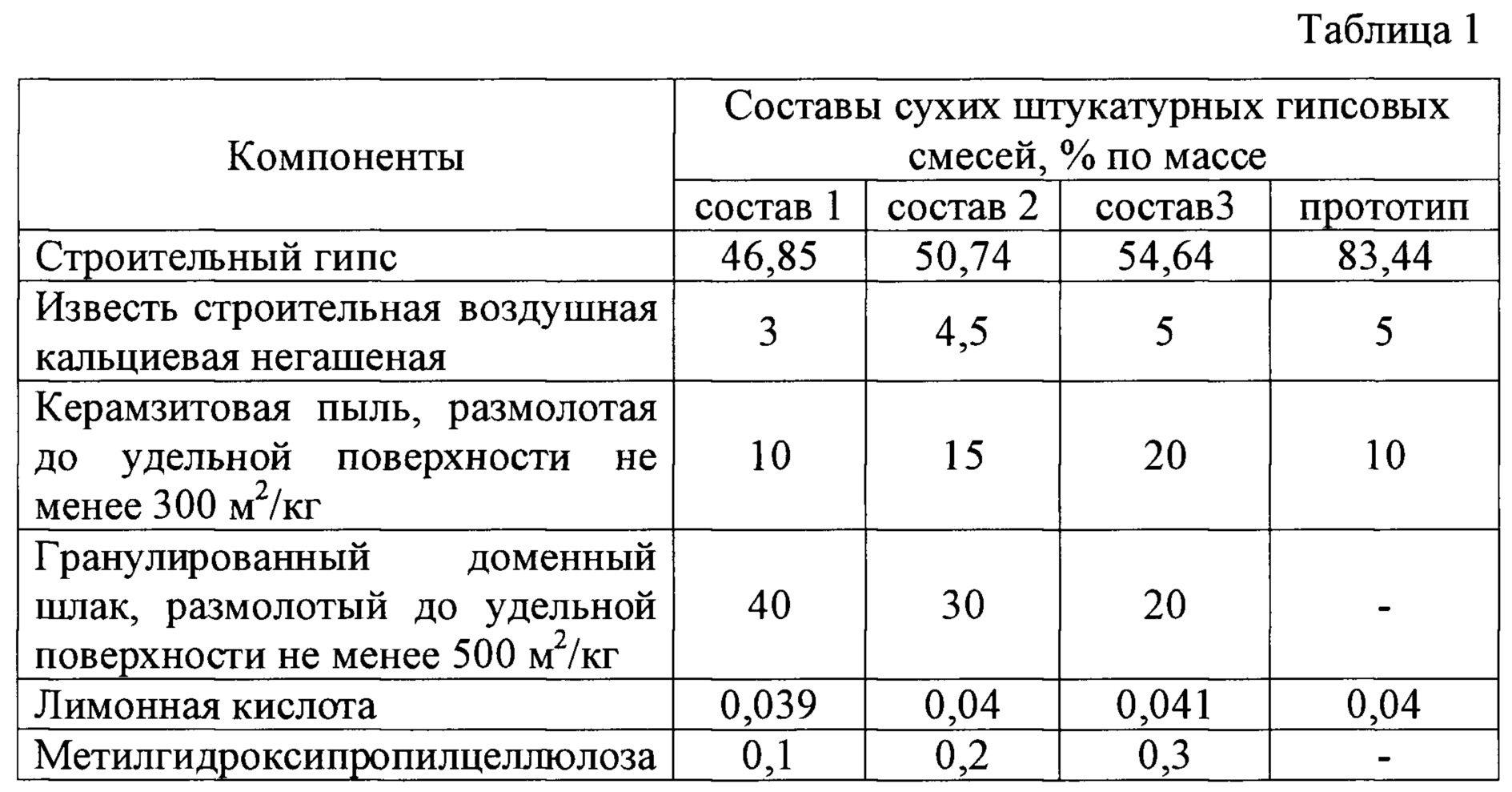 Это понимание будет иметь решающее значение, когда мы перейдем к следующей странице урока 2 по теме калориметрии. Калориметрия — это наука, связанная с определением изменений энергии системы путем измерения теплообмена с окружающей средой.
Это понимание будет иметь решающее значение, когда мы перейдем к следующей странице урока 2 по теме калориметрии. Калориметрия — это наука, связанная с определением изменений энергии системы путем измерения теплообмена с окружающей средой.
Проверьте свое понимание
1. Вода обладает необычно высокой удельной теплоёмкостью. Какое из следующих утверждений логически следует из этого факта?
а.По сравнению с другими веществами горячая вода вызывает сильные ожоги, потому что она хорошо проводит тепло.
б. По сравнению с другими веществами вода при нагревании быстро нагревается до высоких температур.
в. По сравнению с другими веществами, пробе воды требуется значительное количество тепла, чтобы изменить ее температуру на небольшое количество.
2. Объясните, почему большие водоемы, такие как озеро Мичиган, могут быть довольно холодными в начале июля, несмотря на то, что температура наружного воздуха около или выше 90°F (32°C).
3. В таблице ниже описывается термический процесс для различных объектов (обозначены красным жирным шрифтом). Для каждого описания укажите, получает или теряет тепло объект, является ли процесс эндотермическим или экзотермическим, и является ли Q для указанного объекта положительным или отрицательным значением.
| Процесс | Получение или потеря тепла? | Эндо- или экзотермический? | В: + или -? | |
а. | Кубик льда кладут в стакан с лимонадом комнатной температуры, чтобы охладить напиток. | |||
б. | Стакан холодного лимонада стоит на столе для пикника под жарким полуденным солнцем и нагревается до 32°F. | |||
в. | Горелки на электроплите выключаются и постепенно остывают до комнатной температуры. | |||
д. | Учитель достает из термоса большой кусок сухого льда и кладет его в воду. Сухой лед возгоняется, образуя газообразный углекислый газ. | |||
эл. | Водяной пар в увлажненном воздухе попадает на окно и превращается в каплю росы (капли жидкой воды). |
4. Образец металлического цинка весом 11,98 г помещают в баню с горячей водой и нагревают до 78,4°C. Затем его удаляют и помещают в чашку из пенопласта, содержащую 50,0 мл воды комнатной температуры (T=27,0°C, плотность = 1,00 г/мл). Вода прогревается до температуры 28.1°С. Определить удельную теплоемкость цинка.
5. Джейк берет из шкафа банку газировки и наливает ее в чашку со льдом.

 На этикетке может быть указано, что действующее вещество содержит 6 или 8,25% гипохлорита натрия. Не используйте ароматизированные, безопасные для цвета или отбеливатели с добавлением чистящих средств. Если вода мутная, дайте ей отстояться и профильтруйте ее через чистую ткань, бумажное полотенце или кофейный фильтр.
На этикетке может быть указано, что действующее вещество содержит 6 или 8,25% гипохлорита натрия. Не используйте ароматизированные, безопасные для цвета или отбеливатели с добавлением чистящих средств. Если вода мутная, дайте ей отстояться и профильтруйте ее через чистую ткань, бумажное полотенце или кофейный фильтр.
 Посетите веб-сайт Федерального агентства по чрезвычайным ситуациям (FEMA) для получения дополнительных инструкций по подготовке и хранению аварийного запаса воды.
Посетите веб-сайт Федерального агентства по чрезвычайным ситуациям (FEMA) для получения дополнительных инструкций по подготовке и хранению аварийного запаса воды.
 Для дезинфекции воды добавьте одну часть раствора хлора на каждые 100 частей обрабатываемой воды.Это примерно то же самое, что добавить 1 пинту (16 унций) раствора хлора на 12,5 галлонов воды. Если вкус хлора слишком силен, перелейте воду из одной чистой емкости в другую и дайте ей отстояться в течение нескольких часов перед использованием. ОСТОРОЖНО: HTH является очень сильным окислителем. Следуйте инструкциям на этикетке для безопасного обращения с этим химическим веществом и его хранения.
Для дезинфекции воды добавьте одну часть раствора хлора на каждые 100 частей обрабатываемой воды.Это примерно то же самое, что добавить 1 пинту (16 унций) раствора хлора на 12,5 галлонов воды. Если вкус хлора слишком силен, перелейте воду из одной чистой емкости в другую и дайте ей отстояться в течение нескольких часов перед использованием. ОСТОРОЖНО: HTH является очень сильным окислителем. Следуйте инструкциям на этикетке для безопасного обращения с этим химическим веществом и его хранения. Эти таблетки доступны в Интернете или в аптеках и магазинах спортивных товаров. Следуйте инструкциям на этикетке продукта, так как каждый продукт может иметь различную силу действия.
Эти таблетки доступны в Интернете или в аптеках и магазинах спортивных товаров. Следуйте инструкциям на этикетке продукта, так как каждый продукт может иметь различную силу действия. Удельная теплоемкость воды составляет 4,18 Дж/г/°С.
Удельная теплоемкость воды составляет 4,18 Дж/г/°С. 1°С
1°С  5 Дж)/[(12,9 г)•(60,6°С)]
5 Дж)/[(12,9 г)•(60,6°С)] 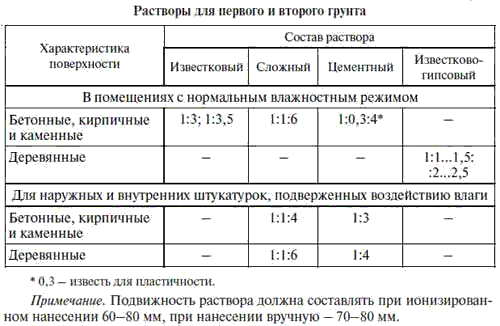 0 г)•(333 Дж/г)
0 г)•(333 Дж/г) 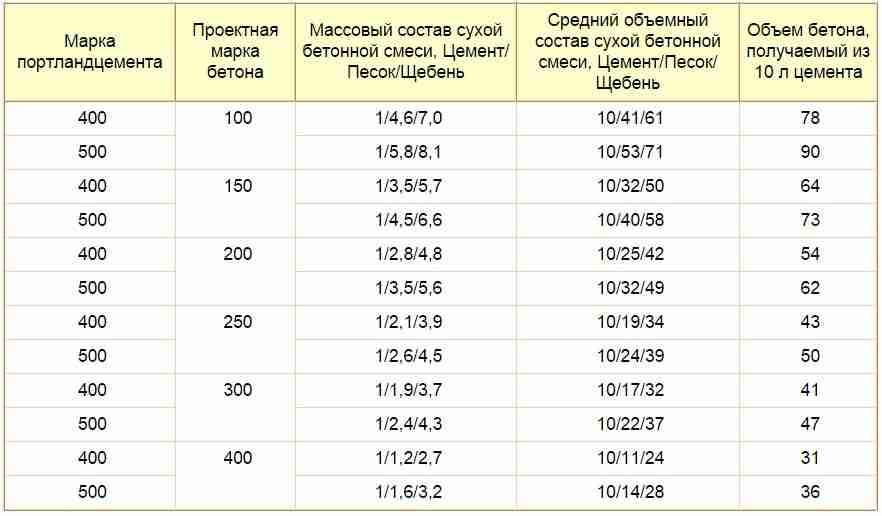 01 Дж/г/°С
01 Дж/г/°С 65 кДж
65 кДж  Поскольку вычислялось пять значений Q, они были помечены как Q 1 , Q 2 и т. д. Такой уровень организации требуется в такой многошаговой задаче, как эта.
Поскольку вычислялось пять значений Q, они были помечены как Q 1 , Q 2 и т. д. Такой уровень организации требуется в такой многошаговой задаче, как эта.